
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
分析 分子式为C9H18O2的有机物A,它能在酸性条件下水解生成B和C,B和C的相对分子质量相等,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,判断5个碳原子醇属于醇以及4个碳原子酸属于酸的同分异构体,从而判断有机物的同分异构体数目.
解答 解:分子式为C9H18O2的有机物A,它能在酸性条件下水解生成B和C,B和C的相对分子质量相等,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,
含有4个C原子的羧酸有2种同分异构体:CH3CH2CH2COOH,CH3CH(CH3)COOH;
含有5个C原子催化氧化能发生银镜反应的醇为含-CH2OH结构的醇,烃基为丁基有4种同分异构体:CH3CH2CH2CH2CH2OH,CH3CH(CH3)CH2CH2OH,CH3CH2CH(CH3)CH2OH,CH3C(CH3)2CH2OH,C(CH3)3CH2OH,
所以有机物的同分异构体数目有2×4=8,
故选B.
点评 本题考查同分异构体数目的判断,清楚饱和一元醇与少一个C原子的饱和一元羧酸的相对分子质量相同以及醇氧化的条件是解题关键,同时掌握组合法的使用,题目难度中等.


科目:高中化学 来源: 题型:解答题

 .
.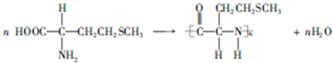 .
. .
.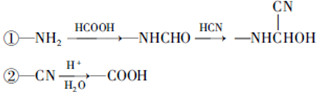
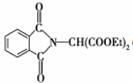
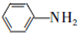 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物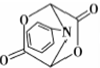 的流程如下:
的流程如下: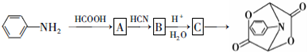
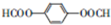
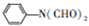 ,C
,C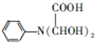 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
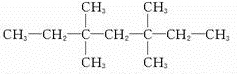
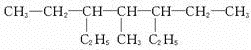
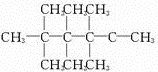
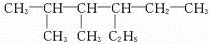
 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C在反应中被还原 | B. | S和KNO3都发生了还原反应 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
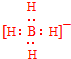 ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
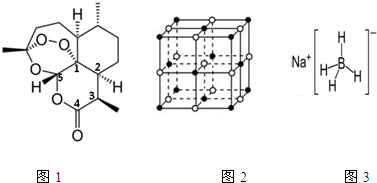
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
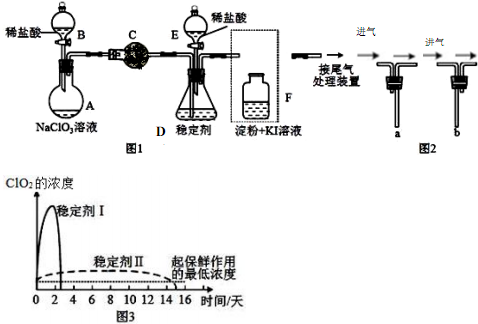
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
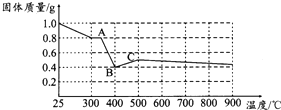 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com