
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。回答下列问题:
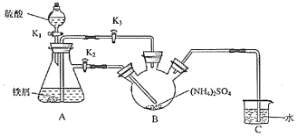
Ⅰ.制取莫尔盐:
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中__________(填仪器名称),将6.0g洁浄铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2molL-1稀硫酸后关闭K1.A装置中反应的离子方程式为______________。
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为___________________________________。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、___、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为_______________________________。
④装置C的作用为___________________,装置C存在的缺点是____________________。
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1molL-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mLKMnO4溶液。滴定反应的离子方程式为_______________________,该样品的纯度为______。
【答案】三颈烧瓶 Fe+2H+=H2↑+Fe2+ A中的液体被压入B中 过滤 抑制亚铁离子水解 液封,防止空气进入三颈烧瓶氧化Fe2+ 不能除去尾气中的H2,甚至发生倒吸 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 98%
【解析】
制取莫尔盐:打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2molL-1稀硫酸,硫酸和铁反应生成氢气,将装置内的空气排出,待大部分铁粉溶解后,打开K3、关闭K2,A中的液体被压入B中,关闭活塞K2、K3,采用100℃水浴蒸发B中水分,可生成莫尔盐,冷却结晶,过滤,用无水乙醇洗涤,可得到莫尔盐晶体,装置C可用于液封,防止空气进入三颈烧瓶氧化Fe2+。
(1)由图可知将0.1mol(NH4)2SO4晶体置于三颈烧瓶中;
(2)①铁与硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+=H2↑+Fe2+;
②待大部分铁粉溶解后,打开K3、关闭K2,A中生成氢气,压强增大,可将A中的液体被压入B中;
③将晶体从溶液中分离出来,可用过滤的方法,硫酸过量,可抑制亚铁离子水解;
④导管插入液面以下,可起到液封作用,防止空气进入三颈烧瓶氧化Fe2+的作用,但不能除去尾气中的H2,装置内冷却后甚至发生倒吸;
(3)亚铁离子具有还原性,与高锰酸钾发生5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,n(KMnO4)=0.01L×0.1mol/L=0.001mol,则20.00mL溶液中n(Fe2+)=0.005mol,则10.0g样品中(NH4)2Fe(SO4)26H2O的物质的量为0.025mol,样品的含量为![]() ×100%=98%。
×100%=98%。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
2CO(g) + 2H2(g)。平衡体系中各组分的体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=________________。
②已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H=-890.3kJmol-1,CO(g) + H2O(g) = CO2(g) + H2(g) △H=+2.8kJmol-1,2CO(g) + O2(g) = 2CO2(g) △H=-566.0kJmol-1,反应CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g)的△H=_______。
2CO(g) + 2H2(g)的△H=_______。
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸。
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_________。
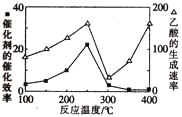
②为了提高该反应中CH4的转化率,可以采取的措施是__________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________。
(3)以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的。写出聚碳酸酯的结构简式:__________。
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.向100mL0.5mol·L-1Fe(NO3)3溶液中通入足量SO2气体,转移电子数为0.05NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.![]() =1×1014的溶液:NH4+、CrO42-、HS-
=1×1014的溶液:NH4+、CrO42-、HS-
B.含大量NO3-的溶液:Fe2+、SO42-、H+
C.水电离产生的c(OH-)=10-13 mol/L的溶液:Mg2+、Na+、Cl-
D.甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入一定量SO2和O2进行反应: 2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
图甲 ,图乙
,图乙
A.图甲中,曲线1表示正反应速率与温度的关系
B.图乙中,a、b两点的反应速率:v(a)>v(b)
C.图甲中,d点时,混合气体的平均摩尔质量不再改变
D.图乙中,c点的正、逆反应速率:v(逆) < v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代张杲《医说》引《集验方》载:每每外出,用雄黄桐子大,在火中烧烟薰脚绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。雄黄的结构如图所示,下列说法错误的是
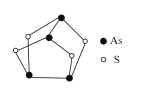
A.雄黄中硫的价态为-2价
B.古代熏蒸的消毒原理与H2O2、酒精相同
C.佩戴药剂香囊是中医独特的防疫措施
D.生活中也可使用火、盐水消毒器具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
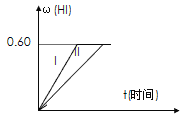
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
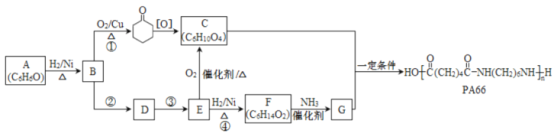
【题目】高分子化合物PA66的合成路线如下:
已知: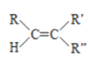
![]() RCHO+
RCHO+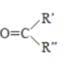
(1)A属于芳香化合物,其结构简式是____________。
(2)①的化学方程式是______________。
(3)D的结构简式是________________。
(4)④的化学方程式是______________。
(5)反应①~④中属于氧化反应的是____________(填序号)。
(6)C和G生成PA66的化学方程式是_____________。
(7)![]() 有多种同分异构体,符合下列条件的有_________种,其中任意一种同分异构体的结构简式是________。
有多种同分异构体,符合下列条件的有_________种,其中任意一种同分异构体的结构简式是________。
i. 为链状化合物且无支链; ii. 为反式结构; iii. 能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废钯催化剂中含钯 5-6%,碳 93-94%,铁 1-2%,铜 0.1-0.2%以及锌等杂质。在实验室中探究采用废钯催化剂制备无水氯化钯,具体流程如下:
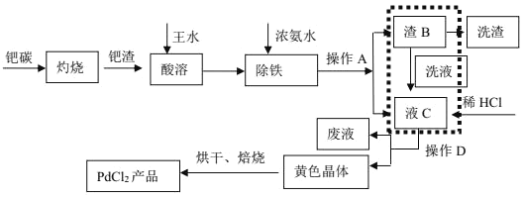
已知:Pd2+、Cu2+、Zn2+等离子均可与氨水生成[M(NH3)n]x+离子,其中[Pd(NH3)2]2+在盐酸中能以[Pd(NH3)2]Cl2 黄色晶体的形式析出。
(1)灼烧钯碳时使用的主要仪器有:酒精灯、玻璃棒、_____(支持仪器省略)。王水溶解过程中会生成 NOCl,NOCl 的结构式为________。
(2)是否进行虚线方框内的操作,对提高钯的回收率至关重要,其主要原因是_____。
(3)最后焙烧之前若不烘干,所得产品中会混有_____杂质。
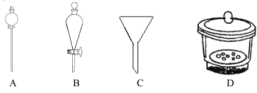
(4)可用“化学放大”法测定样品中的微量 Fe3+:在酸性介质中加入过量的 KI 后用CCl4萃取,分去水相后,用肼(N2H4)的水溶液进行还原并反萃取,还原过程中有无污染的气体生成。再用过量的 Br- 将反萃取出的 I- 氧化成 IO3- ,煮沸除 Br2后,加入过量的 KI,酸化后用Na2S2O3 标准液进行滴定。经上述步骤后,样品含量的测定值放大了_____倍,写出还原过程中发生反应的离子方程式___________,假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为 1∶80,50mL 的水溶液样品,用 10mL 萃取剂萃取,萃取后溶液中残留的样品浓度为原溶液的_______________倍(用分数表示)。完成萃取和反萃取操作,必须选用的仪器有____________(填标号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com