
| A. | CO2的结构式O-C-O | |
| B. | S2-的结构示意图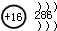 | |
| C. | N2的电子式为  | |
| D. | 质子数为53,中子数为78的碘原子${\;}_{53}^{78}$I |
分析 A.二氧化碳分子中碳原子与氧原子之间形成2对共用电子对;
B.硫原子质子数为16,得到2个电子形成硫离子,核外有18个电子,有3个电子层,最外层有8个电子;
C.氮气分子中含有氮氮三键,两个氮原子的最外层都达到8电子结构;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,存在碳氧双键,结构式为:O=C=O,故A错误;
B.硫原子质子数为16,得到2个电子形成氯离子,核外有18个电子,有3个电子层,最外层有8个电子, 为硫离子,故B错误;
为硫离子,故B错误;
C.氮气分子中含有3对共用电子对,氮原子最外层达到8电子稳定结构,则N2的电子式为: ,故C正确;
,故C正确;
D.质子数为53,中子数为78的碘原子质量数为131,该核素正确的表示方法为:53131I,故D错误;
故选C.
点评 本题考查了常见化学用语的书写判断,题目难度中等,注意掌握离子结构示意图、结构式、电子式、元素符号等化学用语的书写原则,试题有利于培养学生规范答题的能力.


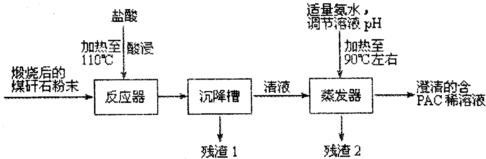
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,Z的体积分数增大 | |
| B. | 增大压强(缩小容器体积),平衡不移动,Z的浓度不变 | |
| C. | 若平衡体系中共有amol气体,再加入amol的X(g),达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持容器体积不变,充入一定量的Z,达到新平衡时,X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 需加入的试剂 | 分离装置 | |
| 苯(乙醇) | ||
| 乙烷(乙烯) | ||
| 乙醇(乙酸) | ||
| 溴苯(Br2) | ||
| 苯(苯酚) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数由大到小的顺序是C>A>B | |
| B. | 原子最外层电子数由多到少的顺序是B>A>C | |
| C. | 离子半径由大到小的顺序是C->B2+>A2- | |
| D. | 原子半径由大到小的顺序是B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 家庭装修用的材料能释放出对人体健康有害的物质主要是甲醛 | |
| B. | 工业上用银镜反应来制镜或保温瓶胆 | |
| C. | 工业酒精因含有毒的甲醇,饮后会使人眼睛失明甚至死亡,所以不能饮用 | |
| D. | 生活中的饮料、糖果等常使用芳香族化合物做香料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com