
【题目】某化学兴趣小组在实验室探究过渡金属元素化合物的性质
I、铁及其化合物

(1)向FeSO4溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了图①装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:___。
(2)某实验小组称量3.60 g草酸亚铁晶体(FeC2O4·2H2O)加热过程中,固体质量变化如图②所示:
①请写出AB段发生反应的化学方程式:___。②C点成分为:___。
(3)向FeCl3溶液中加入过量Na2SO3溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。(简要说明实验步骤、现象和结论,仪器和药品自选)___。
II、铜及其化合物
向2ml0.2mol·L-1Na2SO3溶液中滴加0.2mol·L-1CuSO4溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
(4)用稀硫酸证实沉淀中含有Cu+的实验现象是___。
(5)向洗净的棕黄色沉淀中加入足量KI溶液,产生白色沉淀,继续向上层清液中加入淀粉溶液并没有变蓝的现象出现,请结合离子反应方程式解释不变蓝的原因___。
【答案】①②③④ FeC2O4![]() FeO+CO↑+CO2↑ Fe3O4 取反应后的溶液分成两份,一份滴加KSCN溶液,变血红色;另一份加K3[Fe(CN)6]溶液,产生特征蓝色沉淀即可说明; 有暗红色不溶物生成 I2+SO32-+H2O=2I-+SO42-+2H+
FeO+CO↑+CO2↑ Fe3O4 取反应后的溶液分成两份,一份滴加KSCN溶液,变血红色;另一份加K3[Fe(CN)6]溶液,产生特征蓝色沉淀即可说明; 有暗红色不溶物生成 I2+SO32-+H2O=2I-+SO42-+2H+
【解析】
(1) ①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K;
(2)由图像计算可知A点结晶水已完全失去,继续加热草酸亚铁开始分解产生铁的氧化物,根据铁元素质量守恒可计算B点固体成分为FeO;FeO不稳定,在空气中加热变为Fe3O4;
(3)利用Fe2+的生成说明发生氧化还原反应,利用Fe3+不足却有剩余说明为可逆反应;
(4)注意沉淀本身有Cu2+的干扰;
(5)碘被Na2SO3还原为I-。
(1) 为顺利看到较长时间的白色沉淀,操作正确的顺序是:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K;
答案为①②③④;
(2)由图像计算可知A点结晶水已完全失去,继续加热草酸亚铁开始分解产生铁的氧化物,根据铁元素质量守恒可计算B点固体成分为FeO;①AB段发生反应的化学方程式为:FeC2O4![]() FeO+CO↑+CO2↑;
FeO+CO↑+CO2↑;
②FeO不稳定,在空气中加热变为Fe3O4,故C点成分为Fe3O4;
(3)利用Fe2+的生成说明发生氧化还原反应,利用Fe3+不足却有剩余说明为可逆反应;答案为取反应后的溶液分成两份,一份滴加KSCN溶液,变血红色;另一份加K3[Fe(CN)6]溶液,产生特征蓝色沉淀即可说明;
(4)注意沉淀本身有Cu2+的干扰;用稀硫酸证实沉淀中含有Cu+的实验现象是有暗红色不溶物生成;
(5)碘被Na2SO3还原为I-,发生反应的离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+。


科目:高中化学 来源: 题型:
【题目】根据如图所示的实验装置,回答下列问题:
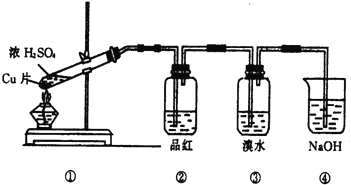
(1)写出铜与浓硫酸反应的化学方程式
(2)证明SO2具有漂白性的现象是 ,再加热该溶液,现象是 .
(3)装置③中的现象是 ,证明SO2具有 .
(4)装置④的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)积极保护生态环境可实现人与自然的和谐共处。
①下列做法会加剧温室效应的是__________(填字母)。
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是_____________(填字母)。
a.使用可降解塑料 b.露天焚烧废旧塑料 c.直接填埋废旧塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹。“禁止燃放烟花爆竹”的标识是_____(填字母)。

(2)合理使用化学知识可提高人们的生活质量。
某品牌牙膏的成分有甘油、山梨酸钾、氟化钠等。
①在上述牙膏成分中,属于防腐剂的是_______________。
②甘油的结构简式为____________;油脂水解可生成甘油和_____________。
③氟化钠(NaF)可与牙齿中的羟基磷酸钙[Ca5(PO4)3OH]反应,生成更难溶的氟磷酸钙[Ca5(PO4)3F],从而达到防治龋齿的目的。写出该反应的化学方程式:____________________。
(3)创新发展材料技术科推动人类社会的进步。
①石墨烯(见下图)可用作太阳能电池的电极,这里主要利用了石墨烯的______________性。

②基础工程建设中常用到水泥、玻璃、钢材等。生成水泥和玻璃都用到的原料是__________;在钢材中添加铬、镍等元素的目的是___________。
③新型战斗机常用纳米SiC粉体作为吸波材料。高温下焦炭和石英反应可制得SiC,石英的化学式为________________;高温分解Si(CH3)2Cl2也可制得SiC,同时还生成CH4和一种常见酸性气体,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用图示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是

A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等八大特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质_____水解而来的。
②配料清单中属于防腐剂的是______。
③小麦中的主要营养物质是_____,写出这种物质完全水解的化学方式:______。
(3)A、B、C三个城市全年雨水的月平均pH变化如图所示。
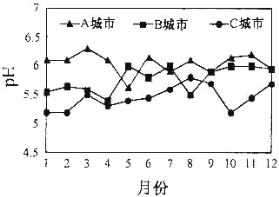
①受酸雨危害最严重的是____城市。
②导致硫酸型酸雨形成主要气体是___,减少燃煤过程产生该气体的措施有_________。
③汽车尾气中含有NO2、NO、CO等有害气体。写出由NO2形成硝酸型酸雨的化学方程式:______;汽车安装尾气净化装置可将NO、CO转化为无害气体,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1丁醇。为提纯含少量正丁醛杂质的1丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1丁醇互溶;③1丁醇的沸点是118℃。
则操作1~4分别是______、_______、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2电池电解尿素CO(NH2)2的碱性溶液制备H2,下列说法不正确的是( )
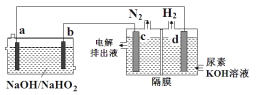
A.电解过程中,电子的流向由a→d→c→b
B.电池的正极反应为:HO2-+2e-+H2O=3OH-
C.电解时,消耗5.4gAl,则产生标况下2.24L N2
D.电极c是阳极,且反应后该电极区pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸奥布卡因临床主要用作眼科表面麻醉用药,我国科研人员最近报道了盐酸奥布卡因新的合成路线:
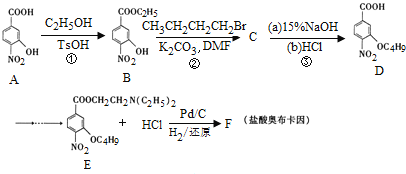
(1)A中含有的官能团名称是 ______ ;A→B的反应类型为 ______ ;
(2)步骤①③的目的是 ______ ;
(3)写出②的化学方程式 ______ ;
(4)G是A的同分异构体,具有下列特征:①苯环上连有硝基和酚羟基,且位于对位;②能发生水解反应,则G的结构有 ______ 种.
(5)下列说法正确的是 ______ ;
a.1molA最多可与含1molNaOH的烧碱溶液反应
b.步骤②中,K2CO3的作用是与生成的HBr反应,使平衡正向移动,提高产率
c.CH3CH2CH2Br系统命名为4-溴丁烷
d.E→F是将-NO2还原为-NH2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com