
【题目】下列关于阿伏加德罗常数的说法中不正确的是( )
A.6.02×1023叫做阿伏加德罗常数
B.12g12C含有的碳原子数就是阿伏加德罗常数的值
C.含有阿伏加德罗常数值个微粒的物质是1mol
D.1.5molH2O含有9.03×1023个水分子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】POCl3是重要的基础化工原料,广泛用于制药、染料、表面活性剂等行业。一种制备POCl3的原理为:PCl3+Cl2+SO2=POCl3+SOCl2。某化学学习小组拟利用如下装置在实验室模拟制备POCl3。有关物质的部分性质如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 |
PCl3 | -93.6 | 76.1 | 1.574 | 遇水强烈水解,易与氧气反应 |
POCl3 | 1.25 | 105.8 | 1.645 | 遇水强烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 1.638 | 遇水强烈水解,加热易分解 |

(1)仪器甲的名称为______________,与自来水进水管连接的接口编号是________________。(填“a”或“b”)。
(2)装置C的作用是___________________,乙中试剂的名称为____________________。
(3)该装置有一处缺陷,解决的方法是在现有装置中再添加一个装置,该装置中应装入的试剂为_________(写名称)。若无该装置,则可能会有什么后果?请用化学方程式进行说明__________________________。
(4)D中反应温度控制在60-65℃,其原因是_______________。
(5)测定POCl3含量。①准确称取30.70gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;④以Fe3+为指示剂,用0.2000mol/LKSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
①滴定终点的现象为____________________,用硝基苯覆盖沉淀的目的是__________________。
②反应中POCl3的百分含量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸受热发生分解反应:H2C2O4![]() H2O+CO↑+CO2↑,某化学兴趣小组为验证草酸分解产物,设计如下实验:
H2O+CO↑+CO2↑,某化学兴趣小组为验证草酸分解产物,设计如下实验:

(1)按图连接好装置,检查气密性的方法是:_________________________________。
(2)实验中B中现象是:______________。
(3)已知C和E中装的是足量同种溶液,写出离子反应方程式:_________________。
(4)实验进行时D中黑色固体会逐渐变成红色。写出化学反应方程式:________________。
(5)实验过程中会有分解产生的气体经过D而未发生反应,采用F进行收集并测量气体体积,读数应注意____________________以便准确读出常压下的气体体积。
(6)某同学查资料了解到有如下反应:CO+PdCl2+H2O=CO2+Pd↓+2HCl,于是建议将浓硫酸换成PdCl2溶液并撤去D及后面的装置,实验完毕后预从PdCl2溶液中分离出固体并称量质量的实验操作依次为:_______,_______,_______,称量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3广泛应用于医药制剂、颜料制造等领域,其制备步骤及装置如下:在三颈烧瓶中加入16.7gFeSO4·7H2O和40.0ml蒸馏水。边搅拌边缓慢加入3.0mL浓H2SO4,再加入2.0gNaClO3固体。水浴加热至80℃,搅拌一段时间后,加入NaOH溶液,充分反应。经过滤、洗涤、干燥得产品。
(1)NaClO3氧化FeSO4·7H2O的离子方程式为_____________。
(2)加入浓硫酸的作用为_________(填标号)。
a.提供酸性环境,增强NaClO3氧化性 b.脱去FeSO4·7H2O的结晶水
c.抑制Fe3+水解 d.作为氧化剂
(3)检验Fe2+已经完全被氧化需使用的试剂是_________。
(4)研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,设计对比实验如下表
编号 | T/℃ | FeSO4·7H2O/g | NaClO3/g | 氧化效果/% |
i | 70 | 25 | 1.6 | a |
ii | 70 | 25 | m | b |
iii | 80 | n | 2.0 | c |
iv | 80 | 25 | 1.6 | 87.8 |
①m=______;n=______。
②若c>87.8>a,则a、b、c的大小关系为___________。
(5)加入NaOH溶液制备Fe(OH)3的过程中,若降低水浴温度,Fe(OH)3的产率下降,其原因是___
(6)判断Fe(OH)3沉淀洗涤干净的实验操作为_________________;
(7)设计实验证明制得的产品含FeOOH(假设不含其他杂质)。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入1 mol·L-1的H2SO4溶液中,乙同学将电极放入1mol·L-1的NaOH溶液中,如图所示。

①写出甲中负极的电极反应式:__________。
②乙中负极反应式为__________,总反应的离子方程式:_______。
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CH3OH(甲醇)和O2 ,则发生了原电池反应,该原电池中的负极反应式为________________;正极反应式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制100mL 2mol/L的NaCl溶液,请回答:
(1)配制时所需固体NaCl物质的量为____________mol,NaCl物质的质量为____________g。
(2)配制过程中需要用到的仪器有:药匙、托盘天平和砝码、烧杯、玻璃杯、____________、胶头滴管。
(3)定容的正确操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加蒸馏水至____________为止。
(4)容量瓶上标有温度、刻度线、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的化工原料,可通过丁烯催化裂解或丁烯与甲醇耦合制备。
Ⅰ.丁烯催化裂解生产丙烯的反应方程式是2C4H8(g)![]() 2C3H6(g)+ C2H4(g)。
2C3H6(g)+ C2H4(g)。
(1)已知C4H8、C3H6、C2H4的燃烧热分别为2710.0 kJ![]() mol-1、2050.0 kJ
mol-1、2050.0 kJ![]() mol-1、1410.0 kJ
mol-1、1410.0 kJ![]() mol-1,则该反应的ΔH=_______ kJ
mol-1,则该反应的ΔH=_______ kJ![]() mol-1。下列操作既能提高C4H8的平衡转化率,又能加快反应速率的是_________。
mol-1。下列操作既能提高C4H8的平衡转化率,又能加快反应速率的是_________。
A.升高温度 B.增大压强
C.增大C4H8的浓度 D.使用更高效的催化剂
(2)某温度下,在体积为2 L的刚性密闭容器中充入2.00 mol C4H8进行上述反应,容器内的总压强p随时间t的变化如下表所示:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
总压强p/kPa | 4.00 | 4.51 | 4.80 | 4.91 | 4.96 | 5.00 | 5.00 |
则0~10 min内υ(C4H8)=_______ mol![]() L-1
L-1![]() min-1,该温度下的平衡常数K=_______kPa(用气体的分压表示)。
min-1,该温度下的平衡常数K=_______kPa(用气体的分压表示)。
Ⅱ.将甲醇转化耦合到丁烯裂解过程中生产丙烯,主要涉及下列反应:
① 2C4H8(g)![]() 2C3H6(g)+ 2H4(g) ΔH>0
2C3H6(g)+ 2H4(g) ΔH>0
② 2CH3OH(g)![]() C2H4(g) + 2H2O(g) ΔH<0
C2H4(g) + 2H2O(g) ΔH<0
③ C2H4(g)+ C4H8(g)![]() 2C3H6(g) ΔH<0
2C3H6(g) ΔH<0
已知:甲醇吸附在催化剂上,可以活化催化剂;甲醇浓度过大也会抑制丁烯在催化剂上的转化。
(3)图1是C3H6及某些副产物的产率与n(CH3OH)/n(C4H8)的关系曲线。最佳的n(CH3OH)/n(C4H8)约为_________。

(4)图2是某压强下,将CH3OH和C4H8按一定的物质的量之比投料,反应达到平衡时C3H6的体积分数随温度的变化曲线。由图可知平衡时C3H6的体积分数随温度的升高呈现先升高后降低,其原因可能是__________________________________________________。

(5)下列有关将甲醇转化耦合到丁烯裂解过程中生产丙烯的说法正确的是________。
A.增大甲醇的通入量一定可以促进丁烯裂解
B.甲醇转化生成的水可以减少催化剂上的积碳,延长催化剂的寿命
C.提高甲醇与丁烯的物质的量的比值不能提高丙烯的平衡组成
D.将甲醇转化引入丁烯的裂解中,可以实现反应热效应平衡,降低能耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJmol-1表示。请认真观察图1,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应。

(2)已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将________转化为________。
(3)某实验小组同学进行如图2的实验,以探究化学反应中的能量变化。实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是________(填“吸热”或“放热”)反应;实验②中,该小组同学在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,该反应是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体![]() 常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
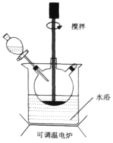
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为____。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因_____
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
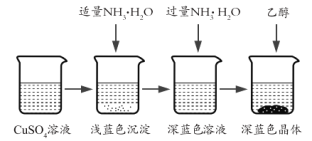
(3)已知浅蓝色沉淀的成分为![]() ,试写出生成此沉淀的离子反应方程式_________。
,试写出生成此沉淀的离子反应方程式_________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是__。
III.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
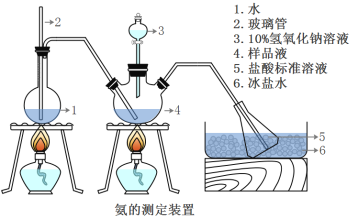
(5)A装置中长玻璃管的作用_____,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏低的原因是_______。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com