
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
分析 将各组溶液两两混合,若现象各不相同,即可鉴别.A中MaOH溶液和AlCl3溶液、B中NaAlO2和HCl溶液、D中AgNO3溶液和氨水溶液滴加顺序不同,现象不同;但是NaHCO3溶液和HCl溶液反应只生成气体,现象相同,不能鉴别,以此解答.
解答 解:A.NaOH溶液和AlCl3溶液滴加顺序不同,现象不同:将NaOH溶液滴加到AlCl3 溶液中,先生成沉淀,当NaOH过量时,沉淀溶解,可鉴别,故A不选;
B.NaAlO2和HCl溶液滴加顺序不同,现象不同:将NaAlO2滴加到HCl溶液中先没有沉淀生成,当滴加到一定程度时有沉淀生成,但将HCl滴加到NaAlO2溶液中,开始就有沉淀生成,当完全反应后再滴加溶液,沉淀逐渐溶解,可鉴别,故B不选;
C.NaHCO3、HCl的反应与量无关,改变滴定顺序,现象相同,不能鉴别,故C选;
D.AgNO3溶液和氨水混合,硝酸银加入氨水中,氨水过量,生成银氨络离子,没有沉淀生成,如将氨水加入到硝酸银溶液中,开始生成沉淀,现象不同,可鉴别,故D不选.
故选C.
点评 本题考查物质的鉴别,题目难度中等,侧重与量有关的离子反应及物质检验现象的考查,注意在解答这类题时要注意利用物质化学特性来选择合适的物质进行区分,两两之间反应,可一一鉴别.


科目:高中化学 来源: 题型:选择题
| A. | HI比HCl稳定 | |
| B. | HI比HCl熔、沸点高 | |
| C. | 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸 | |
| D. | 拆开等物质的量的HI和HCl,HI消耗的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=244.1 kJ•mol-1 | B. | △H=-488.3 kJ•mol-1 | ||
| C. | △H=-996.6 kJ•mol-1 | D. | △H=996.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO、Al2O3均含有氧元素,属于氧化物 | |
| B. | H2SO4、HNO3均为强酸,属于强电解质 | |
| C. | 蓝宝石、明矾的主要成分都是含有铝元素的氧化物 | |
| D. | AlCl3、Na2O2都属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A. | △H=△H1-△H2 | |
| B. | K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 该反应进行时不断分离出H2O,可以提高CO2的转化率和反应速率 | |
| D. | 该反应正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
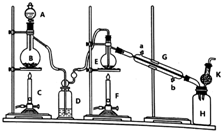 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
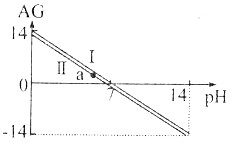
| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com