
| A. | 1 L 0.1mol•L-1的氨水含有0.1NA个OH- | |
| B. | 常温常压下,22.4 LCCl4含有NA个CCl4分子 | |
| C. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g N2O4和NO2的混合气体中,含有NA个氧原子 |
分析 A、一水合氨为弱电解质;
B、常温常压下四氯化碳为液态;
C、亚铁离子和双氧水反应后变为+3价;
D、N2O4和NO2的最简式均为NO2;
解答 解:A、一水合氨为弱电解质,故不能完全电离,故溶液中的氢氧根的个数小于0.1NA个,故A错误;
B、常温常压下四氯化碳为液态,故不能根据其体积来计算其物质的量和分子个数,故B错误;
C、亚铁离子和双氧水反应后变为+3价,故1mol亚铁离子反应后转移NA个电子,故C错误;
D、N2O4和NO2的最简式均为NO2,故23g混合物中含有的NO2的物质的量为0.5mol,故含NA个氧原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 在常温常压下,1molNe含有的原子数为NA | |
| C. | 71gCl2所含原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 科学家在宇宙深处发现了H3+与H3,二者互为同位素 | |
| B. | 焰色反应实验操作过程中,没有铂丝,也可以用光洁无锈的铁丝代替 | |
| C. | N2的结构式为N≡N,电子式为 | |
| D. | Na+的结构示意图 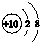 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 12.5% | C. | 17.5% | D. | 25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是白色固体,与冷水作用放出氧气,生成氢氧化钠 | |
| B. | 在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2 | |
| C. | Na2O不稳定,能继续被氧化,生成Na2O2 | |
| D. | Na2O2能与水反应,生成NaOH,所以Na2O2是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
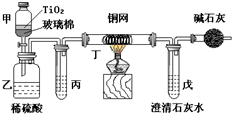 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑧ | B. | ③⑥⑨⑩ | C. | ④⑤⑧⑨ | D. | ④⑤⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com