
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
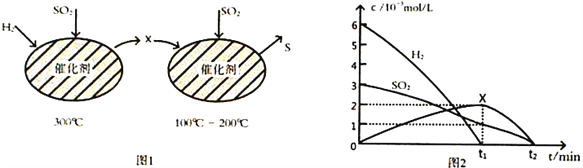
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
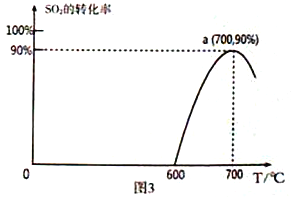
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
【答案】 CH4 (g)+2SO2 (g)=== CO2 (g)+2S (s)+2H2O(l) △H=-295.9 kJ/mol H2S 300℃ 2×10-3/t1 mol/(L· min) 2H2+SO2 ![]() S+2H2O < 36.45 mol/L SO32- +SO2 + H2O === 2HSO3- c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
S+2H2O < 36.45 mol/L SO32- +SO2 + H2O === 2HSO3- c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
【解析】(1)已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,则有
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) △H=-890.3 kJ/mol
②S(s)+O2(g)===SO2(g) △H=-297.2 kJ/mol
根据盖斯定律可知①-②×2即得到CH4和SO2反应的热化学方程式为CH4(g)+2SO2(g)===CO2(g)+2S(s)+2H2O(l) △H=-295.9 kJ/mol。
(2)①氢气与二氧化硫反应生成X,X与SO2反应生成S,反应中X是还原剂,则X为H2S。0~t1时间段内主要是生成X,则反应的温度为300℃,0~t1时间段二氧化硫浓度减少0.002mol/L,则用SO2表示的化学反应速率为0.002mol/L÷t1min=2×10-3/t1mol/(L·min)。②根据原子守恒可知反应中还有水生成,则总反应的化学方程式为2H2+SO2![]() S+2H2O。(3)①达到平衡后,升高温度二氧化硫的转化率降低,说明平衡向逆反应方向进行,该反应的ΔH<0。②a点SO2的转化率是0.9,消耗二氧化硫是0.9mol/L,生成CO2是0.9mol/L,S2(g)是0.45mol/L,剩余SO2是0.1mol/L,因此该温度下的平衡常数为
S+2H2O。(3)①达到平衡后,升高温度二氧化硫的转化率降低,说明平衡向逆反应方向进行,该反应的ΔH<0。②a点SO2的转化率是0.9,消耗二氧化硫是0.9mol/L,生成CO2是0.9mol/L,S2(g)是0.45mol/L,剩余SO2是0.1mol/L,因此该温度下的平衡常数为![]() =36.45。(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为SO32-+SO2+H2O===2HSO3-;25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶质是亚硫酸钠和亚硫酸氢钠的混合溶液,根据亚硫酸的第二步电离常数可知
=36.45。(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为SO32-+SO2+H2O===2HSO3-;25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶质是亚硫酸钠和亚硫酸氢钠的混合溶液,根据亚硫酸的第二步电离常数可知![]() ,因此溶液中各离子浓度的大小关系为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。
,因此溶液中各离子浓度的大小关系为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图中表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数
B. 实验室用图乙装置滴定FeSO4溶液
C. 实验室用图丙装置脱结晶水得无水硝酸铜固体
D. 图丁表示常温下CaSO4在水中的沉淀溶解平衡曲线,图中a点溶液可通过蒸发变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于燃料电池的说法正确的是
A.燃料电池是通过燃烧方式将化学能转换为电能
B.氢氧燃料电池中,通入氢气的一极为正极
C.氢氧燃料电池是一种环境友好电池
D.燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的某试剂充分反应,过滤结晶即可;②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶解,再加入适量的氢氧化镁,充分反应,过滤结晶即可;③为了除上硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为_____________(填化学式)而除去。
(2)①中加入的试剂应该选择_____为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式:______________________________。
(4)下列与方案③相关的叙述中,正确的是__________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.在pH<4 的溶液中Fe3+一定不能大量存在
C.调节溶液pH=4 可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4 的溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2 价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
②比较NH3 和[Cu(NH3)4]2+中H-N-H键角的大小:NH3___________[Cu(NH3)4]2+(填“>”或“<”),并说明理由________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为_______________,N原子的杂化方式为________________。NO3- 的一种等电子体为________________________。
②N2O4会发生类似于水的自偶电离N2O4![]() NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
Ⅱ.CuCl是较为常见的+1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为________________________。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
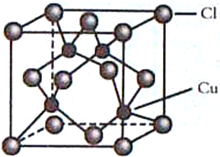
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②设NA为阿伏加德罗常数的值,晶体的密度为ρg/cm3,CuCl的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过分别加入AgNO3、Ba(NO3)2、Mg(NO3)2三种试剂,使某溶液中的Cl-、OH-、CO32-先后沉淀出来,逐一加以分离,则加入三种试剂的顺序是
A. AgNO3、Ba(NO3)2、Mg(NO3)2 B. Mg(NO3)2、Ba(NO3)2、AgNO3
C. Ba(NO3)2、AgNO3、Mg(NO3)2 D. Ba(NO3)2、Mg(NO3)2、AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F( )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:

已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;
②
请回答下列问题:
(1)X的化学名称是_________________。
(2)E生成F的反应类型为_________________。
(3)D的结构简式为_________________。
(4)由B生成C的化学方程式为_________________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式___________、__________。
(6)写出以甲醛、丙醛和乙二醇为主要原料合成软质隐形眼镜高分子材料—聚甲基丙烯酸羟乙酯( )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com