
| 0.5825g |
| 233g/mol |
| 0.5825 |
| 233 |
| 1 |
| 18 |


科目:高中化学 来源: 题型:
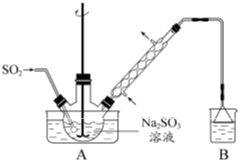 (2012?江苏)[实验化学]次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛.以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
(2012?江苏)[实验化学]次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛.以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省资阳市高二下学期期末考试化学试卷(带解析) 题型:填空题
(9分)食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯的结构简式为 ,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由 (写结构简式)发生加聚反应制得的。
,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由 (写结构简式)发生加聚反应制得的。
(2)假酒中往往甲醇含量超标,若从乙醇和甲醇的混合液中分离出甲醇,下列方法正确的是(填序号) 。
①过滤 ②分液 ③蒸馏 ④结晶
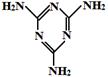
(3)毒奶粉中常加有害物质三聚氰胺(结构简式如图所示),已知1 g三聚氰胺晶体完全燃烧生成N2、CO2和液态水时,放出a kJ热量,1 mol H2O(g)转化为1 mol H2O(l)时放出44 kJ热量,则在101 kPa 120℃三聚氰胺晶体完全燃烧时生成N2、CO2和水蒸气的热化学方程式为:
(4)劣质植物油中的亚油酸(C18H32O2)含量很低,下列有关亚油酸的叙述正确的是(填序号) 。
①亚油酸分子中的含氧官能团为羧基
②亚油酸甘油酯完全硬化时与消耗H2的物质的量之比为1∶2
③亚油酸可发生氧化反应、加成反应、取代反应
④可用酸性KMnO4溶液检验亚油酸甘油酯的皂化反应是否完全
(5)在淀粉中加入吊白块制得粉丝有毒,吊白块又称雕白粉,化学名称为二水合次硫酸氢钠甲醛(化学式为:NaHSO2·CH2O·2H2O,相对分子质量为:154),有漂白作用。已知某种含吊白块的粉丝(不考虑吊白块的损失)1 g中含硫0.32 %,则每千克这种粉丝中含吊白块的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2013届四川省资阳市高二下学期期末考试化学试卷(解析版) 题型:填空题
(9分)食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯的结构简式为
 ,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由
(写结构简式)发生加聚反应制得的。
,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由
(写结构简式)发生加聚反应制得的。
(2)假酒中往往甲醇含量超标,若从乙醇和甲醇的混合液中分离出甲醇,下列方法正确的是(填序号) 。
①过滤 ②分液 ③蒸馏 ④结晶
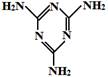
(3)毒奶粉中常加有害物质三聚氰胺(结构简式如图所示),已知1 g三聚氰胺晶体完全燃烧生成N2、CO2和液态水时,放出a kJ热量,1 mol H2O(g)转化为1 mol H2O(l)时放出44 kJ热量,则在101 kPa 120℃三聚氰胺晶体完全燃烧时生成N2、CO2和水蒸气的热化学方程式为:
(4)劣质植物油中的亚油酸(C18H32O2)含量很低,下列有关亚油酸的叙述正确的是(填序号) 。
① 亚油酸分子中的含氧官能团为羧基
② 亚油酸甘油酯完全硬化时与消耗H2的物质的量之比为1∶2
③ 亚油酸可发生氧化反应、加成反应、取代反应
④ 可用酸性KMnO4溶液检验亚油酸甘油酯的皂化反应是否完全
(5)在淀粉中加入吊白块制得粉丝有毒,吊白块又称雕白粉,化学名称为二水合次硫酸氢钠甲醛(化学式为:NaHSO2·CH2O·2H2O,相对分子质量为:154),有漂白作用。已知某种含吊白块的粉丝(不考虑吊白块的损失)1 g中含硫0.32 %,则每千克这种粉丝中含吊白块的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
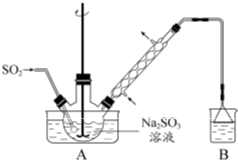 [实验化学]次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛.以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
[实验化学]次硫酸氢钠甲醛(NaHSO2?HCHO?2H2O)在印染、医药以及原子能工业中应用广泛.以Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示) 加入一定量Na2SO3 和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3 溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90益下,反应约3h,冷却至室温,抽滤.
步骤3:将滤液真空蒸发浓缩,冷却结晶.
(1)装置B 的烧杯中应加入的溶液是______.
(2)①步骤2 中,反应生成的Zn(OH)2 会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是______.②冷凝管中回流的主要物质除H2O 外还有______(填化学式).
(3)①抽滤装置所包含的仪器除减压系统外还有______、______(填仪器名称).②滤渣的主要成分有______、______(填化学式).
(4)次硫酸氢钠甲醛具有强还原性,且在120益以上发生分解.步骤3 中不在敞口容器中蒸发浓缩的原因是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com