
| A. | K+、MnO4-、Na+、I- | B. | Mg2+、Na+、NO3-、CO32- | ||
| C. | AlO2-、NO3-、H+、SO42- | D. | CH3COO-、Na+、SO42-、H+、 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液和Ca(OH)2溶液 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Na和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
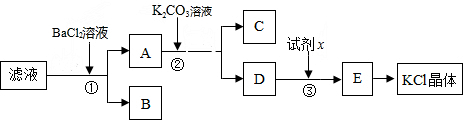
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.1mol | B. | 0.2mol | C. | 0.4mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:1 | B. | 3:1:2 | C. | 7:2:1 | D. | 9:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| D. | 光照过程中,有气泡冒出,溶液的导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
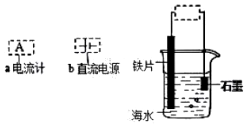
| A. | 接a,该装置将化学能转化为电能 | B. | 接a,石墨是正极 | ||
| C. | 接b,铁片连正极时被保护 | D. | 接b,石墨连正极时石墨上产生气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com