
| A. | H2+CuO═Cu+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | H2+Cl2═2HCl | D. | 2NaOH+Cl2═NaCl+NaClO+H2O |
分析 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析解答.
解答 解:A.该反应中没有极性键的断裂和离子键、非极性键的形成,故A错误;
B.该反应中过氧化钠中离子键和非极性键断裂、水中极性键断裂,氧气中非极性键形成、氢氧化钠中离子键和极性键形成,故B正确;
C.该反应中没有离子键的形成和断裂,没有极性键的断裂和非极性键的形成,故C错误;
D.该反应中没有极性键的断裂和非极性键的形成,故D错误;
故选B.
点评 本题考查化学键的判断,为高频考点,明确离子键和共价键的根本区别是解本题关键,侧重考查学生分析判断能力,注意结合物质构成微粒及微粒之间作用力分析解答.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
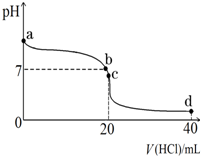 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
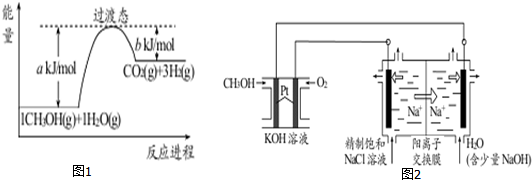
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、PH3、H2S稳定性依次减弱 | |
| C. | NaOH、KOH、Ca(OH)2碱性依次减弱 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷(乙烯):催化剂和H2,加热 | B. | 苯(苯酚):氢氧化钠溶液,分液 | ||
| C. | CO2(SO2):饱和碳酸钠溶液,洗气 | D. | 溴苯(溴):苯和铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,4.6gCH3CH2OH中含有 6NA个C-H键 | |
| C. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
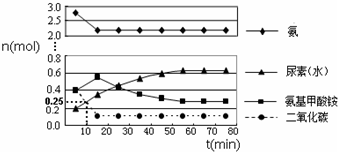
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
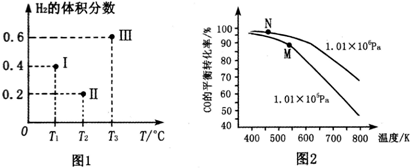
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com