
①用分液漏斗将水和甘油分离 ②用激光棒照射来区分NaCl溶液和蛋白质溶液 ③制乙烯时温度计插到液面之下 ④用CuO作催化剂加热KClO3制O2
其中正确的有
A.①②③ B.②③④ C.②③ D.③④
科目:高中化学 来源: 题型:
| A、原溶液中肯定不含Fe2+、Mg2+、SiO32- | B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | C、原溶液中肯定含有K+、Fe2+、NO3-、SO42-、I- | D、为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)温室效应和资源短缺等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)??CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0
B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
(2)该反应平衡常数K的表达式为________________________________。
(3)温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)________mol·L-1·min-1。
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有________。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
E.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽南协作体高二上学期期中考试化学试卷 题型:填空题
(10分)温室效应和资源短缺 等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)?
等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)?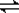 ?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。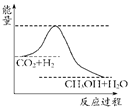
(1)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0
B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
(2)该反应平衡常数K的表达式为________________________________。
(3)温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)________mol·L-1·min-1。
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有________。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
E.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源:2013届年天津市等三校高二上学期期末联考化学试卷 题型:填空题
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
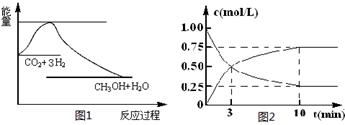
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = mol·(L·min)-1;
H2的转化率w(H2) =
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com