
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
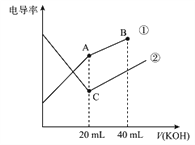
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
【答案】B
【解析】A、相同浓度的CH3COOH溶液和HCl溶液,由于醋酸是弱酸,所以醋酸溶液的导电能力弱于盐酸,图象中起始时曲线①的导电能力弱于曲线②,故A正确;B、图象中A、C两点分别表示KOH与CH3COOH、KOH与HCl恰好完全反应,由于CH3COOK水解使溶液呈碱性,促进了水的电离,而KCl不水解,溶液呈中性,所以C点水电离的c(H+)小于A点水电离的c(H+),故B错误;C、A点为KOH与CH3COOH恰好完全反应生成的CH3COOK溶液,其浓度为c(CH3COOK)= 0.05mol/L= c(K+),由电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+ c(K+),所以c(CH3COO-)+c(OH-)-c(H+)= c(K+)=0.05mol/L,故C正确;D、B点为物质的量浓度均为0.1/3mol/L的CH3COOK和KOH的混合溶液,因CH3COO-水解,所以有c(K+)>c(OH-)>c(CH3COO-)>c(H+),故D正确。本题正确答案为B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Mg﹣AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
A.负极反应式为Mg﹣2e﹣=Mg2+
B.正极反应式为Ag++e﹣=Ag
C.电池放电时Cl﹣由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E不可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关各实验的叙述中正确的是 ( )



A. ①利用CCl4密度大于乙醇,进行CCl4与乙醇混合物的分离
B. ②进行H2、NH3、CO2、Cl2、NO、NO2等气体的收集
C. ③当X选用苯时可进行NH3或HCl的吸收,并防止倒吸
D. ④可用于NH3的干燥,收集并吸收多余NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)2NH3(g)△H2=﹣92.4kJ/mol,有关数据及特定平衡状态见表.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,
起始时乙中的压强是甲容器的倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
①像中T2和T1的关系是:T2T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2 , 3molH2 , 经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 . 保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2 , 达平衡后放出的热量为Q,则Q110.88kJ(填“>”、“<”或“=”).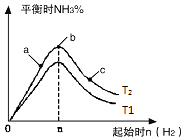
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:①CO(g)+ ![]() O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
②H2(g)+ ![]() O2 (g)=H2O(g);△H=﹣241.8kJmol﹣1则下列说法正确的是( )
O2 (g)=H2O(g);△H=﹣241.8kJmol﹣1则下列说法正确的是( )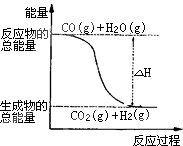
A.H2的燃烧热为241.8kJmol﹣1
B.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41.2 kJmol﹣1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g)+ ![]() O2 (g)=H2O(l);△H>﹣241.8 kJmol﹣1
O2 (g)=H2O(l);△H>﹣241.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组对某硫酸亚铁晶体(FeSO4xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4xH2O中的x= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com