
【题目】为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如图所示。
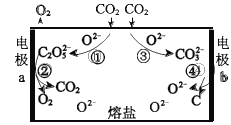
C2O52-可以表示为:[![]() ]2-,下列说法不正确的是
]2-,下列说法不正确的是
A.过程①中有碳氧键断裂
B.过程③中的反应可表示为:CO2+O2- = CO32-
C.过程②中 C2O52-在 a 极上发生了还原反应
D.过程总反应:CO2![]() C+O2
C+O2
【答案】C
【解析】
由装置图可知,a极上,电极反应有:4CO2+2O2-=2C2O52-,2C2O52--4e-=4CO2↑+O2↑,总的电极反应为:2O2--4e-=O2↑;b极上,电极反应有:CO2+O2-=CO32-,CO32-+4e-=C+3O2-,总的电极反应为:CO2+4e-=C+2O2-;熔盐电池的总的化学方程式为:CO2 ![]() C+O2。
C+O2。
A.过程①的离子反应为:2CO2+O2-=C2O52-,其中CO2的结构式为O=C=O,对比CO2和C2O52-的结构式可知,该过程有碳氧键断裂,故A正确;
B.根据题中信息,可以推出过程③中的反应可表示为:CO2+O2-=CO32-,故B正确;
C.过程②中,a极的电极反应为:2C2O52--4e-=4CO2↑+O2↑,该电极反应为氧化反应,故C错误;
D.经分析,熔盐电池的总的化学方程式为CO2 ![]() C+O2,故D正确;
C+O2,故D正确;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学学习小组设计实验制取氨气并探究氨气的有关性质:
(1)实验室制备氨气,下列方法中适宜选用的是 ___________(填编号)
A . 氯化铵溶液与氢氧化钠溶液共热
B. 固体氢氧化钠中滴加浓氨水
C. 固态氯化铵加热分解
D. 固态硝酸铵加热分解
E. 固态氯化铵与熟石灰混合加热
(2)该小组成员设计实验制备氨气并探究氨气的还原性及产物,提供实验装置如图:
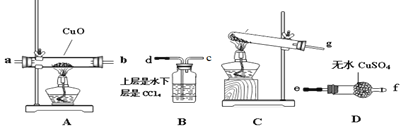
①装置C中发生反应的化学方程式为______________
②根据上述提供的装置正确的连接顺序为____________(用各接口序号表示)
③该装置在设计上有一定的缺陷,你对该装置的改进措施是___________。
(3)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式________
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O__________。已知:Cu2O+2H+=Cu+Cu2+ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国制碱专家侯德榜先生潜心研究制碱技术,发明了侯氏制碱法。工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程如下:
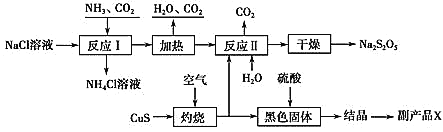
已知:反应Ⅱ包含2NaHSO3Na2S2O5+H2O等多步反应。
(1) 反应Ⅰ的化学方程式为________;在进行反应Ⅰ时,向NaCl溶液中先通入_______(填“CO2”或“NH3”);
(2)“灼烧”时发生反应的化学方程式为__________;
(3)已知Na2S2O5与稀硫酸反应放SO2,其离子方程式为__________。
(4)副产品X化学式为________;生产中可循环利用的物质为____________(化学式)。
(5)为了减少产品Na2S2O5中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为_________,若气体量不足,则会导致___________________,检验产品中是否含有碳酸钠杂质,所需试剂是_________(填编号)。
①酸性高锰酸钾溶液 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH溶液 ⑥稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
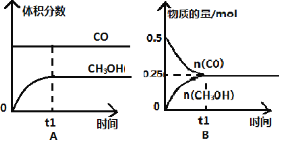


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年具有超常性能的铝离子电池成为研究热点,某化学研究所研发出了以新型石墨烯(Cn) 作正极材料的铝离子电池,可在一分钟内完成充电,其放电时的工作原理如图所示。下列说法不正确的是
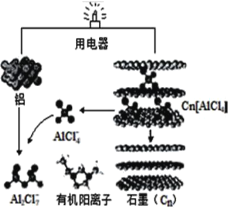
A.充电时,铝电极连接电源负极,该电极有Cn[AlCl4]生成
B.放电时,每生成 1molAl2Cl7-转移电子数目为0.75NA
C.充电时,阴极的电极反应式为4Al2Cl7–+3e–=Al+7AlCl4 –
D.放电时,正极的电极反应式为 Cn[AlCl4]+e–═Cn+AlCl4–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
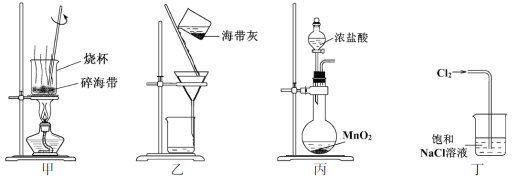
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约 6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
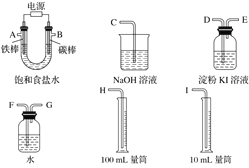
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是 A 接_____,_____接_____; B 接_____,_____接_____。
(2)铁棒接直流电源的_____极;碳棒上发生的电极反应为_____。
(3)能说明氯气具有氧化性的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:浓硫酸易使有机物脱水,如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯时温度计水银球位置应在反应液的液面下
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com