
 2NH3£Øg£©¦¤H£½£92.4 kJ”¤mol£1
2NH3£Øg£©¦¤H£½£92.4 kJ”¤mol£1
| A£®2c1£¾1.5mol”¤L-1 | B£®w3=w1 | C£®2¦Ń1=¦Ń2 | D£®K¼×= KŅŅ= K±ū |
 £Ø1·Ö£©
£Ø1·Ö£© £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£» £¬“š°ø£ŗ0.3 mol”¤L-1”¤min-1£»
£¬“š°ø£ŗ0.3 mol”¤L-1”¤min-1£»


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
| ·Åµē |
| ³äµē |
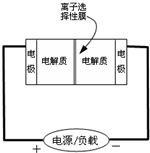
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
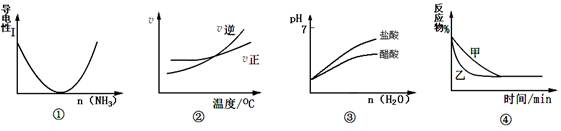
| A£®Ķ¼¢ŁæɱķŹ¾°±ĘųĶØČėŅŅĖįČÜŅŗÖĮ¹żĮæ¹ż³ĢÖŠČÜŅŗµ¼µēŠŌµÄ±ä»Æ |
B£®øł¾ŻĶ¼¢ŚæÉÅŠ¶ĻæÉÄę·“Ó¦A2£Øg£©+3B2£Øg£© 2AB3£Øg£©µÄ¦¤H£¼0 2AB3£Øg£©µÄ¦¤H£¼0 |
| C£®Ķ¼¢Ū±ķŹ¾µČĢå»ż”¢µČpHµÄŃĪĖįÓė“×ĖįČÜŅŗ¼ÓČėµČĮæĖ®Ļ”ŹĶŹ±µÄpH±ä»Æ |
D£®Ķ¼¢ÜæɱķŹ¾Ń¹Ēæ¶ŌæÉÄę·“Ó¦A£Øg£©+B£Øg£© 2C£Øg£©+D£Øg£©µÄÓ°Ļģ£¬ŅŅµÄŃ¹Ēæ“ó 2C£Øg£©+D£Øg£©µÄÓ°Ļģ£¬ŅŅµÄŃ¹Ēæ“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
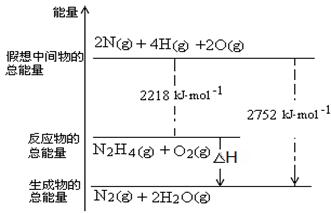
 4NO2(g)+O2(g)£»”÷H£¾0”£·“Ó¦ÖĮ5·ÖÖÓŹ±ø÷ĪļÖŹµÄÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬²āµĆNO2µÄĢå»ż·ÖŹżĪŖ50%”£
4NO2(g)+O2(g)£»”÷H£¾0”£·“Ó¦ÖĮ5·ÖÖÓŹ±ø÷ĪļÖŹµÄÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬²āµĆNO2µÄĢå»ż·ÖŹżĪŖ50%”£ N2O4(g)£¬Ę½ŗāŹ±N2O4ÓėNO2µÄĪļÖŹµÄĮæÖ®±ČĪŖa£¬ĘäĖüĢõ¼ž²»±äµÄĒéæöĻĀ£¬·Ö±šŌŁ³äČėNO2ŗĶŌŁ³äČėN2O4£¬Ę½ŗāŗóŅżĘšµÄ±ä»ÆÕżČ·µÄŹĒ__________”£
N2O4(g)£¬Ę½ŗāŹ±N2O4ÓėNO2µÄĪļÖŹµÄĮæÖ®±ČĪŖa£¬ĘäĖüĢõ¼ž²»±äµÄĒéæöĻĀ£¬·Ö±šŌŁ³äČėNO2ŗĶŌŁ³äČėN2O4£¬Ę½ŗāŗóŅżĘšµÄ±ä»ÆÕżČ·µÄŹĒ__________”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®»Æѧ·“Ó¦µÄĖŁĀŹŌ½“󣬻Æѧ·“Ó¦µÄĻŽ¶ČŌ½“ó |
| B£®»Æѧ·“Ó¦ÖŠ¼ČÓŠĪļÖŹ±ä»Æ£¬ÓÖÓŠÄÜĮæ±ä»Æ |
| C£®»Æѧ·“Ó¦µÄŹµÖŹŹĒ¾É¼üµÄ¶ĻĮŃ£¬ŠĀ¼üµÄŠĪ³É |
| D£®æÉÄę·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬£¬·“Ó¦ŅĄČ»ŌŚ½ųŠŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®“߻ƼĮĶعż½µµĶ»Æѧ·“Ó¦µÄģŹ±ä¼Óæģ»Æѧ·“Ó¦ĖŁĀŹ |
| B£®Ē¦Šīµē³Ų³äµēŹ±£®±źÓŠ”°Ņ»”±µÄµē¼«Ó¦ÓėµēŌ“µÄøŗ¼«ĻąĮ¬ |
| C£®ĪĀ¶Č±£³Ö²»±ä£®ĻņĖ®ÖŠ¼ÓČėÄĘŃĪ¶ŌĖ®µÄµēĄėŅ»¶ØƻӊӰĻģ |
| D£®Ļņ“×ĖįÄĘČÜŅŗÖŠ¼ÓĖ®Ļ”ŹĶŹ±£®ČÜŅŗÖŠĖłÓŠĄė×ÓÅØ¶Č¶¼¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 CH3OH(g) ”÷H = ”Ŗ90.8kJ/mol”£
CH3OH(g) ”÷H = ”Ŗ90.8kJ/mol”£ O2(g)=H2O(g) ”÷H = ”Ŗ241.8kJ/mol£»
O2(g)=H2O(g) ”÷H = ”Ŗ241.8kJ/mol£» CH3OH(g)£¬ĻĀĮŠ±ķŹ¾øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ÓŠ £ØĢī×ÖÄøŠņŗÅ£©”£
CH3OH(g)£¬ĻĀĮŠ±ķŹ¾øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ÓŠ £ØĢī×ÖÄøŠņŗÅ£©”£| A£®ÓŠ1øöH”ŖH¼üÉś³ÉµÄĶ¬Ź±ÓŠ 3øöC”ŖH¼üÉś³É |
| B£®CO°Ł·Öŗ¬Įæ±£³Ö²»±ä |
| C£®ČŻĘ÷ÖŠ»ģŗĻĘųĢåµÄŃ¹Ēæ²»±ä»Æ |
| D£®ČŻĘ÷ÖŠ»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä»Æ |
 H2(g)+ CO2(g) ”÷H£¼0£¬Ä³ĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=1”£ČōĘšŹ¼Ź±c(CO)=1mol?L-1£¬c(H2O)=2mol?L£1£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
H2(g)+ CO2(g) ”÷H£¼0£¬Ä³ĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=1”£ČōĘšŹ¼Ź±c(CO)=1mol?L-1£¬c(H2O)=2mol?L£1£¬ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®SO2”¢Cl2¶¼ÄÜŹ¹Ę·ŗģČÜŅŗĶŹÉ« |
| B£®NH4Cl¾§Ģ唢¹ĢĢåµāŹÜČȶ¼»įĘū»Æ |
| C£®ø£¶ūĀķĮÖ”¢ĘĻĢŃĢĒÓėŠĀÖĘCu(OH)2¹²Čȶ¼ÓŠŗģÉ«³ĮµķÉś³É |
| D£®±½”¢ŅŅĻ©¶¼ÄÜŹ¹äåĖ®ĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
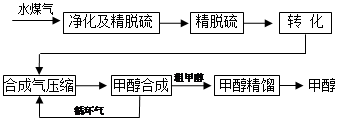
 CO£Øg£©+H2£Øg£©£¬“Ė·“Ó¦ŹĒĪüČČ·“Ó¦”£¢Ł“Ė·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ £»
CO£Øg£©+H2£Øg£©£¬“Ė·“Ó¦ŹĒĪüČČ·“Ó¦”£¢Ł“Ė·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ £»| A£®¼ÓČėC£Øs£© | B£®¼ÓČėH2O£Øg£© | C£®ÉżøßĪĀ¶Č | D£®Ōö“óŃ¹Ēæ |
 CO (g)+2H2O (g) +519KJ”£¹¤ŅµÉĻŅŖŃ”ŌńŗĻŹŹµÄ“߻ƼĮ£¬·Ö±š¶ŌX”¢Y”¢ZČżÖ֓߻ƼĮ½ųŠŠČēĻĀŹµŃé£ØĘäĖūĢõ¼žĻąĶ¬£©
CO (g)+2H2O (g) +519KJ”£¹¤ŅµÉĻŅŖŃ”ŌńŗĻŹŹµÄ“߻ƼĮ£¬·Ö±š¶ŌX”¢Y”¢ZČżÖ֓߻ƼĮ½ųŠŠČēĻĀŹµŃé£ØĘäĖūĢõ¼žĻąĶ¬£© CH3OH(g)+181.6kJ”£T4”ęĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżĪŖ160”£“ĖĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČėCO”¢H2£¬·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄÅضČČēĻĀ£ŗ
CH3OH(g)+181.6kJ”£T4”ęĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżĪŖ160”£“ĖĪĀ¶ČĻĀ£¬ŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČėCO”¢H2£¬·“Ó¦µ½Ä³Ź±æĢ²āµĆø÷×é·ÖµÄÅضČČēĻĀ£ŗ| ĪļÖŹ | H2 | CO | CH3OH |
| ÅضČ/£Ømol”¤L£1£© | 0.2 | 0.1 | 0.4 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com