
【题目】有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是

A.图中的甲池为电解池,乙池为原电池
B.a极发生的电极反应为SO2-2e-+2H2O===SO42-+4H+
C.N2O5在c极上产生,c极的电极反应为N2O4-2e-+H2O===N2O5+2H+
D.当消耗标况下2.24 L SO2时,若要维持硫酸的浓度不变则应补充水11.6 mL
【答案】B
【解析】
A.根据图示,图中的甲池相当于燃料电池,为原电池,乙池的两极均为惰性电极,为电解池,故A错误;
B. 甲池相当于燃料电池,为原电池,通入二氧化硫的为负极,发生氧化反应,生成硫酸,因此a极发生的电极反应为SO2-2e-+2H2O=SO42-+4H+,故B正确;
C.c是阳极,d是阴极,阳极上N2O4放电生成N2O5,电极反应为N2O4-2e-+2HNO3=2N2O5+2H+,故C错误;
D.标况下2.24 L SO2的物质的量n(SO2)=![]() =0.1mol,电池的负极反应式为:SO2-2e-+2H2O=4H++SO42-,消耗水0.2mol,生成硫酸0.1mol,质量为:0.1mol×98g/mol=9.8g,消耗水的质量为0.2mol×18g/mol=3.6g,氢离子向右侧正极区定向移动0.2mol,质量为0.2g H+,设补充xmLH2O,则
=0.1mol,电池的负极反应式为:SO2-2e-+2H2O=4H++SO42-,消耗水0.2mol,生成硫酸0.1mol,质量为:0.1mol×98g/mol=9.8g,消耗水的质量为0.2mol×18g/mol=3.6g,氢离子向右侧正极区定向移动0.2mol,质量为0.2g H+,设补充xmLH2O,则![]() ×100%=50%,解得:x=13.6mL,故D错误;
×100%=50%,解得:x=13.6mL,故D错误;
故选B。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物 a(![]() )、b(
)、b(![]() ) 、c(
) 、c(![]() )的说法正确的是
)的说法正确的是
A.a、b 互为同系物
B.C 中所有碳原子可能处于同一平面
C.b 的同分异构体中含有羧基的结构还有 7 种(不含立体异构)
D.a 易溶于水,b 、c 均能使酸性高猛酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸苯乙酯的反应如图:
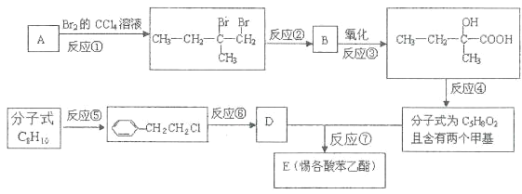
(1)写出物质B的分子式:_____。
(2)写出反应类型:反应①:_____反应;反应⑥:_____反应。
(3)写出反应试剂和反应条件:反应②_____;反应⑤_____。
(4)写出化学反应方程式:反应④_____;反应⑦_____。
(5)如何检验 中的溴元素?_____。
中的溴元素?_____。
(6)写出符合下列条件惕格酸的同分异构体的结构简式:_____。条件:与惕格酸含相同官能团,且也有两个甲基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展了一系列的化学实验活动。
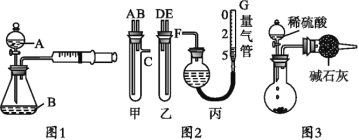
请你参与实验并完成下列问题:
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g 锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录______得到反应速率为x mol·(L·min)-1。实验开始时检查该装置气密性的方法是_____。
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于___、__仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是___;
③仪器甲、乙接口的连接方式如下:A连接__,B连接___,C连接___(填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差___,请你分析其中使测定结果可能偏大的主要原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:
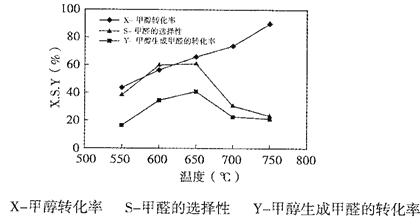
①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________;
②反应历程i的活化能___________(填“>、“<”或“=”)CH3OH(g)![]() HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________(填“>”、“<”或“=”)反应历程ⅲ的速率。
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________h。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①0.1molL﹣1氨水中,c(OH﹣)=c(NH4+)
②10mL 0.02 molL﹣1 HCl溶液与10mL 0.02 molL﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
③在0.1 molL﹣1CH3COONa溶液中,c(OH﹣)=c(CH3COOH)+c(H+)
④0.1 molL﹣1某二元弱酸的强碱盐NaHA溶液中,c(Na+)=2c(A2﹣)+c(HA﹣)+c(H2A)
A.①②③B.②③C.②③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示,下列说法正确的是
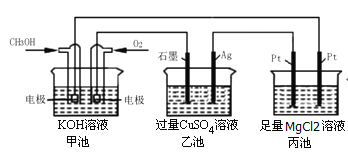
A.甲池是电能转化为化学能的装置,乙、丙是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种气态烃组成的混合气完全燃烧后所得到的CO2和H2O的物质的量随混合烃的总物质的量的变化如下图所示,则下列对混合烃的判断正确的是
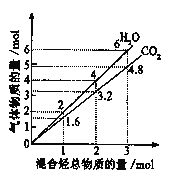
①一定有乙烯;②一定有甲烷;③一定有丙烷;④一定无乙烷;⑤可能有乙烷
A.①②⑤B.②④C.②⑤D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com