
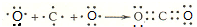 .
.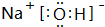 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.分析 Z原子有2个电子层,最外层电子数是核外电子数的$\frac{2}{3}$倍,设最外层电子数为a,则$\frac{2}{3}$(2+a)=a,解得a=4,故Z为C元素;则X、Y原子质子数之和为25-6=19,设X原子的质子数为x,Y原子的质子数为y,则x+y=19,而Z与Y的原子序数之和比X的原子序数的2倍还多1,则6+y=2x+1,联立方程解得x=8,y=11,即X为O元素,Y为Na,据此解答.
解答 解:Z原子有2个电子层,最外层电子数是核外电子数的$\frac{2}{3}$倍,设最外层电子数为a,则$\frac{2}{3}$(2+a)=a,解得a=4,故Z为C元素;则X、Y原子质子数之和为25-6=19,设X原子的质子数为x,Y原子的质子数为y,则x+y=19,而Z与Y的原子序数之和比X的原子序数的2倍还多1,则6+y=2x+1,联立方程解得x=8,y=11,即X为O元素,Y为Na.
(1)由上述分析可知,X为氧元素,故答案为:氧;
(2)用电子式表示CO2的形成过程为: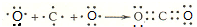 ,
,
故答案为: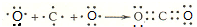 ;
;
(3)Na2O对应水化物为NaOH,由钠离子与氢氧根离子过程,电子式为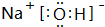 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: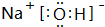 ;离子键、共价键;
;离子键、共价键;
(4)X的氢化物为H2O,H2O分子之间存在氢键,沸点比同主族的氢化物的熔沸点明显偏高,
故答案为:H2O分子之间存在氢键.
点评 本题考查位置结构性质的关系应用,推断元素是解题关键,注意理解掌握用电子式表示化学键或物质的形成过程.


科目:高中化学 来源: 题型:解答题
 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种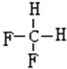 和
和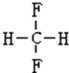 F.
F.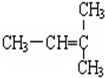 和
和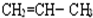 G.
G.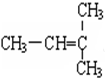 和
和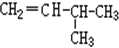
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 状态 | 密度/g•cm3 | 沸点/℃熔点/℃ |
| 乙醇 无色液体 | 0.79 | 78.5/-130 |
| 1,2-二溴乙烷 无色液体 | 2.2 | 132/9 |
| 乙醚 无色液体 | 0.71 | 34.6/-116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
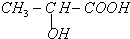 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 鸡蛋白溶液中分别滴入饱和硫酸铵和醋酸铅溶液 | 均有固体析出 | 均发生变性 |
| B | 溴水中分别加入苯酚和环己烯 | 溴水均褪色 | 均发生加成反应 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 适量水玻璃加入稀盐酸中, 振荡得透明溶液,用激光笔照射 | 有丁达尔效应 | 有硅酸胶体生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
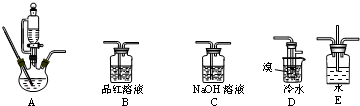
 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
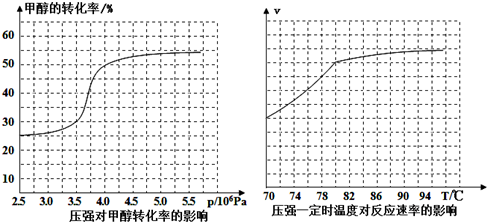
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com