

 .
. 分析 (1)浓硫酸增重为生成水的质量,碱石灰增重为燃烧生成二氧化碳的质量,通过碱石灰后的气体燃烧又生成0.88g二氧化碳,说明烃燃烧时有CO生成,计算水的物质的量、二氧化碳总物质的量,根据原子守恒确定烃的实验式,烷烃分子中H原子数目达最大,烷烃通式为CnH2n+2,且烃分子中H原子为偶数,进而确定其分子式;
(2)①a的化学式为C6H12,与氢气加成生成2-甲基戊烷,则a为烯烃,2-甲基戊烷结构简式为(CH3)2CHCH2CH2CH3,利用还原碳碳双键方法确定a的可能数目,相连碳原子上均至少含有1个H原子可以形成碳碳双键;
②b能使溴水和酸性高锰酸钾褪色,含有碳碳双键,PMR谱中只有一个信号,分子中只有1种H原子,应含有4个甲基,分别连接碳碳双键上;
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,不含不饱和键,可萃取溴水中的溴,PMR谱中也只有一个信号,应为环己烷.
解答 解:(1)浓硫酸增重为生成水的质量,其物质的量为$\frac{1.35g}{18g/mol}$=0.075mol,故n(H)=0.15mol,碱石灰增重为燃烧生成二氧化碳的质量,通过碱石灰后的气体燃烧又生成0.88g二氧化碳,说明烃燃烧时有CO生成,二氧化碳总物质的量为$\frac{1.76g+0.88g}{44g/mol}$=0.06mol,即n(C)=0.06mol,则烃分子中N(C):N(H)=0.06:0.15=2:5,故该烃的实验式为C2H5,烷烃分子中H原子数目达最大,烷烃通式为CnH2n+2,令该烃分子式为C2aH5a,则5a≤4a+2,解得a≤2,由于烃分子中H原子为偶数,a只能取2,故该烃的分子式为:C4H10,
故答案为:C2H5;C4H10;
(2)①a的化学式为C6H12,与氢气加成生成2-甲基戊烷,则a为烯烃,2-甲基戊烷结构简式为(CH3)2CHCH2CH2CH3,相连碳原子上均至少含有1个H原子可以形成碳碳双键,故符合条件的a的有4种,
故答案为:4;
②b能使溴水和酸性高锰酸钾褪色,含有碳碳双键,PMR谱中只有一个信号,分子中只有1种H原子,应含有4个甲基,分别连接碳碳双键上,则b的结构简式为(CH3)2C=C(CH3)2,名称为:2,3-二甲基-2-丁烯,
故答案为:(CH3)2C=C(CH3)2;2,3-二甲基-2-丁烯;
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,不含不饱和键,可萃取溴水中的溴,PMR谱中也只有一个信号,c应为环己烷,结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物分子式确定、限制条件同分异构体的书写等,(1)中注意利用烃的最简式、结合烷烃的通式判断分子式,难度中等.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 | |
| B. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| C. | 常见的合成纤维有涤纶、尼龙等,涤纶纤维是以苯二甲酸、乙二酸为主要原料合成的 | |
| D. | 硫、白磷、臭氧、碳-60、氩、水等物质固态时都是分子晶体,分子内都存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子序数不可能为Z>Y>X | B. | X可能是非金属元素 | ||
| C. | Z一定在Y的下一周期 | D. | Y不可能在Z的下一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 蛋白质、淀粉和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 福尔马林、葡萄糖溶液与新制氢氧化铜悬浊液共热,都会有砖红色沉淀产生 | |
| D. | 构成物质微粒的种类和数量不同、彼此的结合方式多样,决定了物质的多样性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 用量筒量取20 mL 0.5000 mol•L-1H2SO4溶液于烧杯中,加水80mL配制成0.1000mol•L-1H2SO4溶液 | |
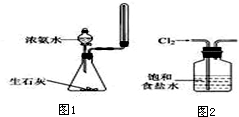
| C. | 实验室用图1所示装置制取少量氨气 | |
| D. | 实验室用图2所示装置除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

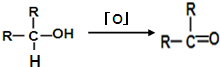
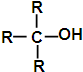
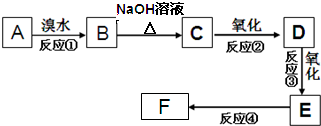

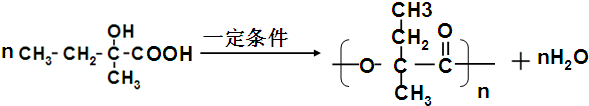
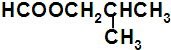 、
、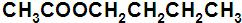 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
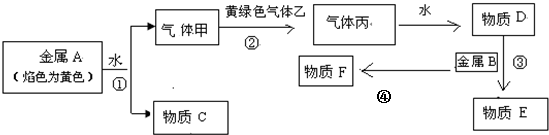
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

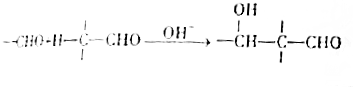
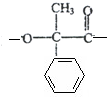
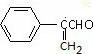 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$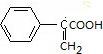 +Cu2O+2H2O
+Cu2O+2H2O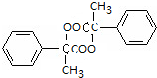
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com