
| ����� | �� | �� | �� |
| ����ʱ����ζ | ������ζ | ��ֽ��ζ | �ս���ë��ζ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��6mol C+2mol D |
| B��1mol A+0.5mol B+1.5mol C+0.5mol D |
| C��1mol A+0.5mol B+1.5mol C |
| D��4mol A+2mol B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
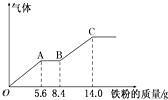 ijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ�������ܽ�9.6g������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ����֪����ֻ����ԭΪNO���壩�����з�������������ǣ�������
ijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ݣ�������һ��������ͭ�ۣ�������ܽ�9.6g������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ����֪����ֻ����ԭΪNO���壩�����з�������������ǣ�������| A��ԭ�������HNO3�����ʵ���Ϊ0.1 mol |
| B��OA�β�������NO��AB�εķ�ӦΪFe+2Fe3+�T3Fe2+��BC�β������� |
| C���ڶ�����Һ����������ΪFeSO4 |
| D��H2SO4Ũ��Ϊ2.5 mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״���£�1.8 g H2O�����е�������ΪNA |
| B��1 L 1 mol/L��Na2CO3��Һ�к��е�CO32-��ĿΪNA |
| C��25��ʱ��1 L pH=13�� Ba��OH��2��Һ�к��е�OH-��ĿΪ0.2NA |
| D����״���£�2.24 L ���������������������Һ��ȫ��Ӧת�Ƶĵ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ҷ���أ���ɫ�� |
| B���������ƣ���ζ�� |
| C��̼���ƣ����ɼ� |
| D���������ƣ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| HCl |
| ʵ�� ��� | ��ʼŨ�� c/mol?L-1 | ����ɫ��ʧ ����ʱ�� t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| �� | 0.8 | 0.2 | 0.001 | 290 |
| �� | 1.6 | 0.2 | 0.001 | 145 |
| �� | 0.8 | 0.4 | 0.001 | 145 |
| �� | 0.8 | 0.2 | 0.001 | 580 |
| A��v ��Br2����c��CH3COCH3�������� |
| B������c��Br2����v ��Br2����С |
| C������c��HCl����v ��Br2������ |
| D��ʵ��ں͢۵�v ��Br2����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
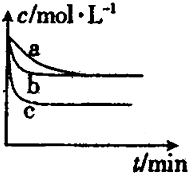 1000��ʱ�������ƿ�������������Ӧ��Na2SO4��s��+4H2��g��?Na2S��s��+4H2O��g������ش��������⣺
1000��ʱ�������ƿ�������������Ӧ��Na2SO4��s��+4H2��g��?Na2S��s��+4H2O��g������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ɵ�����������ʵ���Ũ�ȵ�һԪ���NaOH��Һ��Ϻ����γɵ���Һ |
| B��c��H+��=1.0��10-7mol?L-1����Һ |
| C��pH=14-pOH����Һ |
| D��pH=pOH����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����CuSO4��Һ����ȡ����ͭ |
| B��Ũ����Ļӷ� |
| C����Ũʳ��ˮ�еõ��Ȼ��ƾ��� |
| D����CCl4��ȡ��ˮ�е��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com