
【题目】下列说法正确的是
A. Na与H2O的反应是熵减的放热反应,该反应能自发进行
B. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态+2价铜离子M能层电子排布式是___________;第4周期中基态原子未成对电子数与铜原子相同的元素有________种。
(2)Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒_________。SCN-对应的酸有硫氰酸(H-S-CN)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是_______(填名称),原因是_____________________。
(3)Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为__________;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是__________。
(4)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,前者熔点较高,其原因是___________。
(5)Cu3N 的晶胞(立方)结构如下图所示:
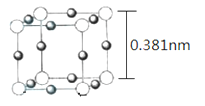
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
②Cu3N 晶体的密度为____________ g·cm-3。(NA表示阿伏伽德罗常数的值,列出计算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N 是一种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子的核外电子排布式是_____________;最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________。
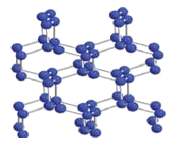
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经X射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是________。
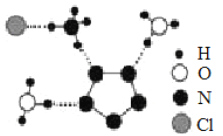
A.所有N 原子的价电子层均有孤对电子 B.两种阳离子均含有配位键
C.两种阳离子不是等电子体 D.阴阳离子之间只存在离子键
(4)NH3 与F2 反应生成NF3 和NH4F,这四种物质中,沸点由高到低的顺序是______;NF3中氮元素显_______价;属极性分子的有_________________。
(5)立方氮化硼称为超硬材料。晶胞结构如图所示:
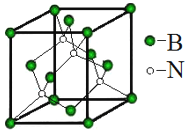
硼原子的配位数是__________。若晶胞参数为anm,则晶体的密度为____g·cm3 (用NA 表示阿伏伽德罗常数的值,列出代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲和乙为中学化学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
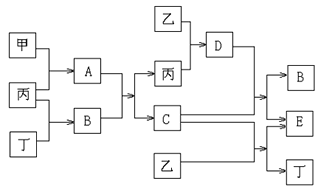
(1)A和E的化学式分别为_____________、____________;
(2)A+B→C+丙的化学方程式:__________________________________________ ;
(3)D+C→B+E的化学方程式:__________________________________________ ;
(4)1mol甲和1mol乙混合投入到足量的B中,在标准状况下,最多能产生丁气体______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下:
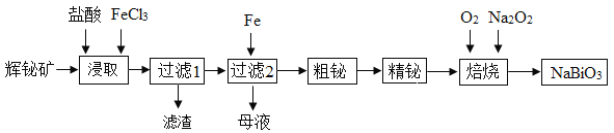
已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有______(任写一条);过滤1的滤渣的主要成分有______(填化学式)。
(2)浸取时加入过量浓盐酸的目的是______;“母液”中通入气体X后可循环利用,气体X为______(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式______;当消耗标准状况下4.48 L O2时,转移电子的数目是______。
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当c(Pb2+)=10-5 mol·L-1时恰好完全沉淀,所得溶液中c(Cu2+)∶c(Bi3+)=______。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。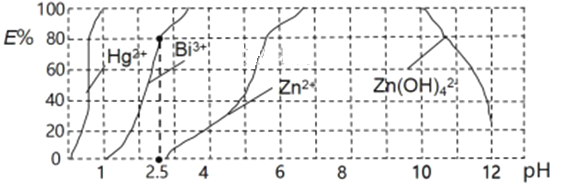
①当调节pH=2.5时,铋(Bi)的存在形式有______。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
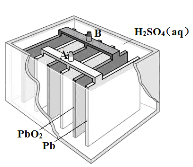
下列说法不正确的是
A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l)
B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接
C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接
D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研究出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是( )
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl的化合价相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com