
【题目】用下图装置可以测定混合气体中ClO2的含量:
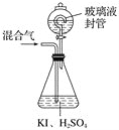
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
(1)锥形瓶内ClO2与碘化钾反应的离子方程式为____________________________。
(2)玻璃液封装置的作用是_______________________。
(3)V中加入的指示剂通常为_____,滴定至终点的现象是_______。
(4)测得混合气中ClO2的质量为________ g。
【答案】2ClO2+10I-+8H+=2Cl-+5I2+4H2O 吸收残留的ClO2气体(避免碘的逸出) 淀粉溶液 溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 0.027 00
【解析】
(1)由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
(2)玻璃液封装置可防止有害气体逸出;
(3)淀粉遇碘单质变蓝;
(4)由关系式2ClO2![]() 5I2
5I2![]() 10S2O32-可求。
10S2O32-可求。
(1)由分析可知,ClO2氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
(2) ClO2气体易溶于水,玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出);
(3)V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色;
(4)由关系式2ClO2![]() 5I2
5I2![]() 10S2O32-,则m(ClO2)=
10S2O32-,则m(ClO2)=![]() =0.027 00g。
=0.027 00g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分类是科学研究的重要方法,下列物质分类正确的是( )
A. 非电解质:乙醇、氯气B. 酸性氧化物:NO、![]()
C. 胶体:豆浆、葡萄糖溶液D. 离子化合物:NaH、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
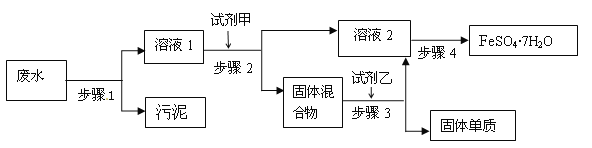
(1)步骤1的主要操作是___,需用到的玻璃仪器除烧杯外还有___。
(2)固体混合物是____(填化学式)
(3)步骤3中发生反应的化学方程式为___。
(4)步骤4中涉及的操作是:蒸发浓缩、___、过滤、洗涤、干燥。
(5)火法制得的粗铜中常混有少量氧化亚铜(Cu2O),氧化亚铜溶于稀硫酸溶液变蓝。试写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌—碘溴液流电池,其工作原理如图所示。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )

A. 放电时,a电极反应为I2Br-+2e-=2I-+Br-
B. 充电时,b电极每增重0.65g,溶液中有0.01mol I-被氧化
C. 放电时,溶液中离子的数目增大
D. 充电时,a电极接外电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是( )
A. 实验室制取氨气
B. 测定化学反应速率
C. 验证非金属性:N﹥C﹥Si
D. 实现反应:Cu+2H2O![]() Cu(OH)2+H2
Cu(OH)2+H2![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过查阅资料发现用KClO3和浓盐酸也可以制备氯气。为此该小组利用如图装置在实验室制取Cl2并探究其有关性质:
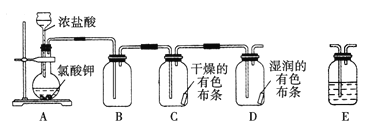
(1)装置A中存在一处错误,改正这处错误:______________。
(2)配平装置A中发生反应的化学方程式:____KClO3+____HCl(浓)=__KCl+___Cl2↑+___H2O,此反应中氧化产物与还原产物的物质的量之比为 ____________。请用单线桥标出该反应电子转移的方向和数目 ____________________。
(3)为了除去氯气中的氯化氢,需要在装置A、B之间添加装置E,装置E中所盛装的试剂为____。为了探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,装置E在整套装置中的添加位置为____(选填序号)。
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
(4)将氯气通入冷的石灰乳中,即可制得以______________(填化学式)为有效成分的漂白粉,发生反应的化学方程式为__________________________。
(5)另外一个学习小组就环境保护方面指出了上述装置的缺陷并给出了改进措施。该改进措施是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁![]() 是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
已知:①氮化镁极易与水反应;②实验室在加热条件下用饱和![]() 溶液和饱和
溶液和饱和![]() 溶液混合制备
溶液混合制备![]() ;③焦性没食子酸溶液用于吸收少量
;③焦性没食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制备氮化镁。
他们选择下列装置设计实验(装置可重复使用):
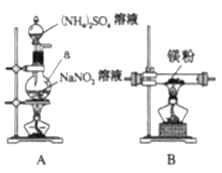
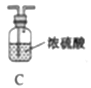

(1)仪器a的名称是____,氮化镁的电子式是____。
(2)气体从左至右,装置连接顺序为____。(填代号)
(3)写出A中发生反应的化学方程式:____。
(4)用化学方法检验产品中含有氮化镁![]() ,设计实验方案:____。
,设计实验方案:____。
Ⅱ.测定产品纯度。
利用如图装置测定氮化镁产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是__。
(6)取产品质量为wg,开始量气管读数为![]() ,最终量气管读数为
,最终量气管读数为![]() (折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
(折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上被称为“世界八大公害”和“20 世纪十大环境公害”之一的洛杉矶光化学烟雾事件使 人们深刻认识到了汽车尾气的危害性。汽车尾气中氮氧化物和碳氢化合物受紫外线作用可产 生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )
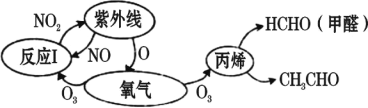
A.烟雾是一种固溶胶,其分散剂是空气B.O2 和 O3 是氧的两种同素异形体
C.反应 I 属于氧化还原反应D.NO2 不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)15.8gKMnO4的物质的量是___,所含原子数目为___,其所含氧元素与___molNaClO中所含氧元素的质量相同。
(2)相同条件下,相同质量的Al(OH)3和Na2O2中氧原子的个数比是___;相同物质的量的NH4+与OH-所含电子个数之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com