
| A. | 外观 | B. | 分散质粒子的大小 | ||
| C. | 是否能通过滤纸 | D. | 是否有丁达尔效应 |
科目:高中化学 来源: 题型:解答题
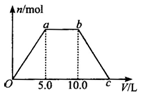 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2O | CO | CO2 | H2 | |
| 甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/mol | 0.20 | 0.20 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②③ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始物质的量mol | 4分钟后平衡时的物质量mol | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4rmol/(L•min) | |
| B. | 平衡时,放出的热量:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com