
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属铁可以将金属铜从其盐中置换出来,但是活泼金属钠和盐的反应一定是和盐中的水反应;
B.硫酸和氢氧化钡反应生成水和硫酸钡沉淀;
C.稀盐酸为强酸,醋酸为弱酸,醋酸在离子方程式中需要保留分子式;
D.二氧化碳和二氧化硫均能使澄清的石灰水变浑浊.
解答 解:A.铁排在金属铜的前面,金属铁可以将金属铜从其盐中置换出来,但是活泼金属钠和盐的反应是先和盐中的水反应,不会置换出其中的金属,反应的离子方程式为:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑,两个反应不能类推,故A错误;
B.硫酸和氢氧化钡反应生成水和硫酸钡沉淀,离子反应方程式为:Ba2++2H++2OH-+SO42-=2H2O+BaSO4↓,稀硫酸与NaOH溶液的离子方程式为:H++OH-=H2O,两个反应的离子方程式不同,不能类推,故B错误;
C.水垢的主要成分为碳酸钙,碳酸钙与醋酸的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-、与盐酸的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,两个反应的离子方程式不同,不能类推,故C错误;
D.二氧化碳和二氧化硫均能使澄清的石灰水变浑浊,如果气体过量会变澄清,碳酸钙和亚硫酸钙均是难溶于水的盐,碳酸氢钙和亚硫酸氢钙是易溶于水的,可以类推,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,本题中明确反应实质为解答关键.


科目:高中化学 来源: 题型:选择题
| A. | 分子式和结构都相同,性质可能相同 | |
| B. | 分子式相同,结构不同,化学性质一定不相同 | |
| C. | 相对分子质量一定相同、官能团一定不同 | |
| D. | 相对分子质量和各元素质量分数一定相同,化学性质不一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:14C | B. | HF的电子式: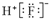 | ||
| C. | Cl-离子的结构示意图: | D. | 氧化铝的化学式:AlO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
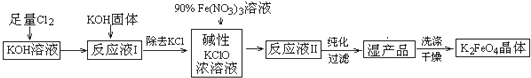
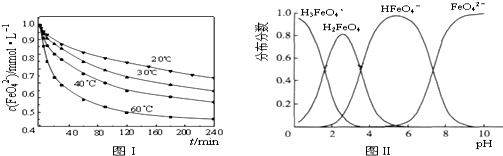
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素及其化合物的学习和应用是中学化学的主要任务之一.
元素及其化合物的学习和应用是中学化学的主要任务之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
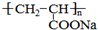 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图: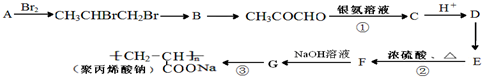
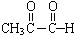 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$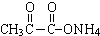 +3NH3+2Ag↓+H2O.
+3NH3+2Ag↓+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数是2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
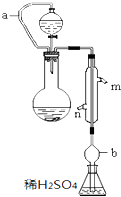 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com