
(本题10分)
元素的单质及其化合物有着广泛的用途。请根据元素周期表中第三周期元素相关知识回答下列问题。
完成下列填空:
23.按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
A.原子半径和简单离子半径均减小
B.金属性减弱,非金属性增强
C.氧化物对应的水化物碱性减弱,酸性增强
D.单质的熔点降低
24.原子最外层电子数与次外层中p亚层电子数相同的元素名称是__________,磷元素原子最外层电子排布的轨道表示式是________________________________。
25.已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是___________________________________。
26.晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________________________________。
27.KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: _______________
(共10分)23.B; 24.硫  (2分)
(2分)
25.MgO熔点高,熔融时耗能大,增加生产成本 AlCl3是共价化合物,熔融时难导电
26.SiCl4(g)+2H2(g)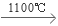 Si(s)+4HCl(g) ΔH=+0.025a kJ/mol(2分)
Si(s)+4HCl(g) ΔH=+0.025a kJ/mol(2分)
27.4KClO3 KCl+3KClO4(2分)
KCl+3KClO4(2分)
【解析】
试题分析:23.A.在同一周期的元素中,随原子序数递增,原子半径逐渐减小,而元素的原子形成的简单离子,由于金属阳离子具有上一周期的惰性气体原子的结构,非金属阴离子具有同一周期的惰性气体的原子结构。对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小。对于电子层结构不同的离子来说,离子核外电子层数越多,离子半径就越大。错误;B.同一周期的元素,原子半径逐渐减小,原子失去电子的能力逐渐减弱,获得电子的能力逐渐增强,因此元素的金属性减弱,非金属性增强,正确;C.元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强;元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,氧化物可能有多种价态,故不能说氧化物对应的水化物碱性减弱,酸性增强,错误;D.同一周期的元素形成的单质的晶体类型有金属晶体、原子晶体、分子晶体,熔化时断裂的作用力性质不同,因此不能比较单质的熔点的变化规律,错误;
24.在第三周期的元素中,原子最外层电子数与次外层中p亚层电子数相同的元素名称是硫,15号元素磷元素原子最外层电子数是5个,最外层电子的排布的轨道表示式是 ;
;
25.MgO、MgCl2都是离子晶体,熔化时断裂的是离子键。工业制镁时,电解MgCl2而不电解MgO的原因是由于MgO离子键强,断裂离子键消耗的能量大,物质的熔点高,熔融时耗能大,增加生产成本;制铝时,电解Al2O3而不电解AlCl3的原因是AlCl3是共价化合物,熔融时破坏的是分子间作用力,难导电;
26.n(Si)=1120g÷28g/mol=40mol,吸收能量是a kJ,则产生1mol的晶体硅吸收的能量是a/40KJ=0.025a kJ
/mol,故该反应的热化学方程式是:SiCl4(g)+2H2(g)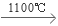 Si(s)+4HCl(g) ΔH=+0.025a kJ/mol;
Si(s)+4HCl(g) ΔH=+0.025a kJ/mol;
27. KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。则根据题意可得该反应的化学方程式是:4KClO3 KCl+3KClO4。
KCl+3KClO4。
考点:考查元素周期表、元素周期律的应用、原子结构与元素性质和位置的关系、原子核外电子排布的轨道表达式的书写、物质电解原料的选择及原因、化学方程式和热化学方程式的书写。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
在同温同压下,用等质量的H2、CH4、CO2、HCl四种气体分别吹起四个气球,其中是由CO2吹起的是

查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
一定温度下,反应N2+O2  2NO在密闭容器中进行,下列措施不改变化学反应速率的是
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
A.缩小体积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省乐山市高三第一次调查研究考试理综化学试卷(解析版) 题型:实验题
仅用下表提供的实验器材和药品,就能达到相应实验目的的是
编号 | 实验器材 | 实验药品 | 实验目的 |
A | 托盘天平(带砝码)、100mL容量瓶、量筒、烧杯、药匙、玻玻棒 | NaCl固体、蒸馏水 | 配制100 mL一定物质的量浓度的NaCl溶液 |
B | 大试管、长颈漏斗、有孔塑料板、导管及橡皮塞、集气瓶、玻璃片、火柴 | 稀盐酸、块状石灰石 | 制取并收集二氧化碳气体 |
C | 碱式滴定管、酸式滴定管、胶头滴管、铁架台(带铁夹)、锥形瓶 | 己知浓度的NaOH溶液、待测盐酸、蒸馏水、白纸 | 测定稀盐酸的物质的量浓度 |
D | 铁架台(带铁夹)、酒精灯、大试管、集气瓶、导管及橡皮塞 | 氯化铵 | 制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:填空题
(本题共12分)
l,6-己二酸(G)是合成尼龙(一种高分子合成纤维)的主要原料之一,可用含六个碳原子的有机化合物氧化制备。A通过氧化反应制备G的合成路线如下(可能的反应中间物质为B、C、D、E和F)。
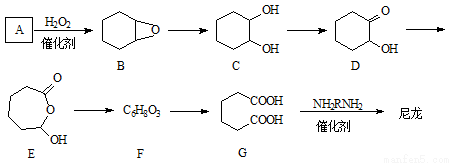
完成下列填空:
46.化合物A中含碳87.8%,其余为氢,A的名称为___________________。
47.B到C的反应类型为______________。
48.F的结构简式为______________________________。
49.在上述中间物质中,不同环境氢原子最多的是_________,最少的是_________(填化合物代号)。
50.由G合成尼龙的化学方程式为_________________________________________________
51.写出由A通过两步反应制备1,3-环己二烯的合成路线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
等质量的下列物质与足量稀硝酸反应,放出NO气体的物质的量最多的是
A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三上学期阶段四考试化学试卷(解析版) 题型:选择题
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2 mol,则NaOH的浓度为
A.2mol/L B.1.8mol/L C.2.4 mol/L D.3.6 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①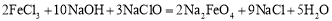
②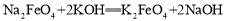 。下列说法不正确的是
。下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com