
����Ŀ���±���Ԫ�����ڱ���һ���֣��û�ѧ����ش���������:
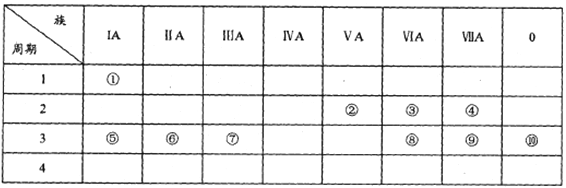
��1���뻭��Ԫ���������ӵĽṹʾ��ͼ:________��
��2���ۢݢ���ԭ�Ӱ뾶��С�����˳��Ϊ________(��Ԫ�ط���)��
��3��������������������Ӧˮ����ļ���ǿ��Ϊ_____>____(�ѧʽ)��
��4���ۢ�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĵ���ʽΪ_______��
��5���õ���ʽ��ʾ�������γɵĻ�����Ĺ���:_________��
II.�ɱ�����~���е�һ�ֻ���Ԫ���γɵij�������A��B��C�ɷ������·�Ӧ(����������ȥ)����ش���������:
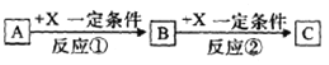
��1����X��һ�ֳ������ɽ������ʣ���C��ˮ��Һ�еμ�AgNO3��Һ������������ϡ����İ�ɫ�����������C��Һ�н������ӵķ�����_______����֪��������Һ�иý��������ܱ�˫��ˮ������д���÷�Ӧ�����ӷ���ʽ:___________��
��2����A��B��CΪ����ͬһ����Ԫ�ص��������XΪǿ�A��Һ��C��Һ��Ӧ����B����B�Ļ�ѧʽΪ___________��
���𰸡� 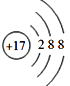 O<S<Na NaOH Al(OH)3 Na��[
O<S<Na NaOH Al(OH)3 Na��[![]()
![]() ]2��Na��
]2��Na�� ![]() �ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ�� H2O2+2Fe2++2H+===2Fe3++2H2O Al(OH)3
�ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ�� H2O2+2Fe2++2H+===2Fe3++2H2O Al(OH)3
����������.����Ԫ���������ڱ��е�λ��������֪��Ԫ�طֱ�Ϊ����ΪHԪ��, ��ΪNԪ��, ��ΪOԪ��, ��ΪFԪ��, �� ΪNaԪ��, ��ΪMgԪ��,��ΪAlԪ��, ��ΪSԪ��, ��Ϊ Cl Ԫ������ ΪArԪ����
��1��Ԫ�آ�ΪCl��![]() ����������Ϊ17�����������Ϊ18����3�����Ӳ������������Ϊ2��8��8,�������ӵĽṹʾ��ͼΪ��
����������Ϊ17�����������Ϊ18����3�����Ӳ������������Ϊ2��8��8,�������ӵĽṹʾ��ͼΪ��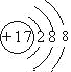 ����ȷ��:
����ȷ��: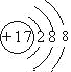 ��
��
��2����ΪOԪ������ ΪNaԪ������ΪSԪ����ͬ����Ԫ�ش�����ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����������ԭ�Ӱ뾶��С����ΪO<S<Na����ȷ��: O<S<Na ��
��3���� ΪNaԪ��, ��ΪAlԪ�����ݺ͢ߵ�����������Ӧˮ����ΪNaOH�� Al(OH)3 ��Ԫ�صĽ�����Խǿ������������Ӧˮ������Ծ�Խǿ����˼���NaOH >_ Al(OH)3 ����ȷ�𰸣�>��
��4���� ΪNaԪ��, ��ΪOԪ��, �ۢ�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������Ϊ�������ƣ�������Ϊ���ӻ��������ʽΪ ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
��5����ΪMgԪ��, ��Ϊ Cl Ԫ�أ��Ȼ�þΪ���ӻ�����γɹ������е��ӵ�ʧ���õ���ʽ��ʾ�γɵĻ�����Ĺ���: ![]() ����ȷ����
����ȷ����![]() ��
��
II. ��1����C��ˮ��Һ�еμ�![]() ��Һ������������ϡ
��Һ������������ϡ![]() �İ�ɫ������C�к���ClԪ����X��һ�ֳ������ɽ�����������AΪ������BΪ�Ȼ�����CΪ�Ȼ���������C�е�������Ϊ���������������Լ�KSCN��Һ����ˮ������������Ϊ:�ȵμ�KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ(����NaOH��Һ���Ȳ�����ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ)����������Һ�����������ܱ�˫��ˮ���������ӷ�ӦΪH2O2+2Fe2++2H+===2Fe3++2H2O����ȷ��: �ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ���� H2O2+2Fe2++2H+===2Fe3++2H2O ��
�İ�ɫ������C�к���ClԪ����X��һ�ֳ������ɽ�����������AΪ������BΪ�Ȼ�����CΪ�Ȼ���������C�е�������Ϊ���������������Լ�KSCN��Һ����ˮ������������Ϊ:�ȵμ�KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ(����NaOH��Һ���Ȳ�����ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ)����������Һ�����������ܱ�˫��ˮ���������ӷ�ӦΪH2O2+2Fe2++2H+===2Fe3++2H2O����ȷ��: �ȼ���KSCN��Һ���Ժ�ɫ���ټ�����ˮ�Ժ�ɫ�����������������Һ��������ɫ������Ȼ���ɻ���ɫ������ɺ��ɫ���� H2O2+2Fe2++2H+===2Fe3++2H2O ��
��2����A��B��CΪ����ͬһ����Ԫ�ص�����������XΪǿ�������A��Һ��C��Һ��Ӧ����![]() ��CΪƫ����������A��C��Ӧ�����ӷ�ӦΪ
��CΪƫ����������A��C��Ӧ�����ӷ�ӦΪ![]() �T
�T![]() ��,��ȷ��Al(OH)3��
��,��ȷ��Al(OH)3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)�������жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����
2NH3(g)��CO2(g)�������жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����
A. 2v(NH3) �� v(CO2)
B. �ܱ���������ѹǿ����
C. �ܱ������л�������ƽ��Ħ����������
D. �ܱ������ж�����̼�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�� T��Q��R��W ��Ԫ�����ڱ��е�λ����ͼ��ʾ������ T �������������������� ��������ȣ����ǵ����������ˮ��������Ϊ�ס��ҡ���������������������ȷ���ǣ� ��
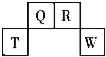
A. �ס��ҡ����������Ⱦ��ֽ�
B. �����¶���Ũ��Һ���� T �������Ƶ�������ʢװ
C. ����Ũ��Һ�� Q �ĵ��ʼ��ȷ�����Ӧ�������������Ϊ 1��2 ����������
D. R ���������ڿ������������������ÿ��γɹ⻯ѧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش�����������
��1�������������ļ��������������з��������ٵ���________________����״���������С����_____________________��
��1gH2 ��2.408��1023��CH4���� ��10.8gH2O ����״����6.72LCO2
��2������ƽ����ʽ��___KClO3+____HCl��Ũ��=___KC1+____ ClO2��+___Cl2��+__H2O��__________
��3����Һ��������ȡ���������ƶ����ӵ�Ũ�Ⱥ����������������Ũ��Խ�����������Խ�࣬��Һ��������Խǿ������Ũ�Ⱦ�Ϊlmol/L�����µ������Һ����K2CO3 ��AgNO3 ��NaHSO4 ��Al2(SO4)3��H2SO4 ��Ba(OH)2����Щ��Һ�е���������ǿ����__________���������������������������____________��
��4����12.4gNa2R��Na+Ϊ0.4mol����Na2R��Ħ������Ϊ____________��
��5����0.2L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ���û����Һ��CuCl2�����ʵ���Ũ��Ϊ____________ molL-1��

��6����ͼ��ʾ�ľ�ʾ��־����һ��____________����ѡ���������

A.��ȼƷ B.�綾Ʒ C.��ʴƷ D.��ըƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦI2+I��I ![]() �ﵽƽ��ʱc��I
�ﵽƽ��ʱc��I ![]() �����¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
�����¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 
A.ͼ�з�Ӧ���е�״̬Dʱ��һ����v����v��
B.A���B��Ļ�ѧƽ�ⳣ����ͬ
C.��B����Һ�����¶�ʱ���÷�Ӧ��v������v��
D.����KI��ҺŨ��������I2���ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������һ�ָ߷��ӻ�����ڹ�ҵ�Ϻ����������Ź㷺��;����ҵ�Ϻϳ��л���������Ϊ��

����˵������ȷ����
A. ��Ӧ�ٵ�ԭ�������ʴ�100%
B. ��Ӧ���ǼӾ۷�Ӧ
C. ��Է�������Ϊ86���������ϩ�����������ͬ�����ŵ��л�����5��
D. ����ϩ�������ʹ���Ը��������ɫ��Ҳ��ʹBr2/CCl4��ɫ������ԭ����ͬ
���𰸡�D
��������A����Ӧ��Ϊ�ӳɷ�Ӧ��û�и������ԭ��������Ϊ100%��ѡ��A��ȷ��B����Ӧ��Ϊ̼̼˫�������ļӾ۷�Ӧ���÷�ӦΪ�� ��ѡ��B��ȷ��C����Է�������Ϊ86���������ϩ�����[CH2=C(CH3)COOCH3]������ͬ�����ŵ��л���Ӧ�ú���һ��������һ��̼̼˫����̼ԭ����Ϊ4����HCOOCH=CHCH3��HCOOCH2CH=CH2��CH3COOCH=CH2��CH2=CHCOOCH3��HCOOC(CH3)=CH2��5�֣�ѡ��C��ȷ��D������ϩ������ܱ����Ը������������ʹ����ɫ��Ҳ�����巢���ӳɷ�Ӧ��ʹBr2��CCl4��Һ��ɫ������ԭ������ͬ��ѡ��D����ȷ����ѡD��
��ѡ��B��ȷ��C����Է�������Ϊ86���������ϩ�����[CH2=C(CH3)COOCH3]������ͬ�����ŵ��л���Ӧ�ú���һ��������һ��̼̼˫����̼ԭ����Ϊ4����HCOOCH=CHCH3��HCOOCH2CH=CH2��CH3COOCH=CH2��CH2=CHCOOCH3��HCOOC(CH3)=CH2��5�֣�ѡ��C��ȷ��D������ϩ������ܱ����Ը������������ʹ����ɫ��Ҳ�����巢���ӳɷ�Ӧ��ʹBr2��CCl4��Һ��ɫ������ԭ������ͬ��ѡ��D����ȷ����ѡD��
�����͡���ѡ��
��������
4
����Ŀ������ͼ��װ�ý���ʵ���ܳɹ������Ӧʵ�����

A. ͼ1:֤���ǽ�����ǿ����C��Si B. ͼ2:�Ʊ�����������
C. ͼ3:����Ⲣ���ձ� D. ͼ4:��ȡ���ռ���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com