
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为akJ | |
| B. | 因CuSO4•5H2O(s)═CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4(s)溶于足量水时,放出热量为bkJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于dkJ |
分析 A.根据NaOH固体溶于水要放热;
B.根据无水硫酸铜溶解为溶液时,先放热变成五水硫酸铜,五水硫酸铜再溶吸收热量,最终表现为放热,放出的热量是两次热量变化之差;
C.燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,氢气燃烧反应是放热反应,逆向是吸热反应;
D.根据N2(g)+3H2(g)?2NH3为可逆反应,不能进行到底.
解答 解:A.NaOH固体溶于水要放热,故1 mol NaOH固体与足量的稀盐酸反应,放出的热量大于a kJ,故A错误;
B.CuSO4•5H2O(s)═CuSO4(s)+5H2O(l)△H=+b kJ/mol,故1 mol CuSO4(s)与水生成CuSO4•5H2O,放出bkJ热量,生成的CuSO4•5H2O溶于水时溶液吸热,所以1 mol CuSO4(s)溶于水时,放出的热量是两次热量变化之差,小于b kJ热量,故B错误;
C.燃烧热是指1 mol物质完全燃烧生成稳定氧化物时所放出的热量,氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+2c kJ/mol,故C错误;
D.根据N2(g)+3H2(g)?2NH3为可逆反应,不能进行到底,故向某容器中通人1 mol N2与3 mol H2充分反应后,放出的热量小于d kJ,故D正确;
故选D.
点评 本题考查了物质溶解过程中的能量变化、盖斯定律的运用以及可逆反应的特征,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 原子半径呈周期性变化 | D. | 元素主要化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
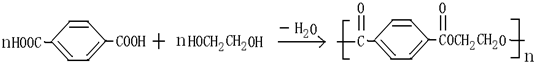
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的结构式: | |
| B. | 次氯酸的结构式为:H-Cl-O | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | NH3的电子式: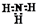 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
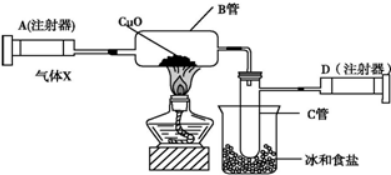
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com