
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
A.0.005 mol
B.0.010 mol
C.0.020 mol
D.0.030 mol
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:简答题
有机物G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。其中A是一种相对分子质量为70的烃,核磁共振氢谱有四个峰且峰面积之比为6:2:1:1;B是一种芳香族含氧衍生物,相对分子质量在100-130之间,B中含氧元素的质量分数为13.1%,F可以使溴的四氯化碳溶液褪色。
已知:

请回答下面的问题:
(1)化合物A的结构简式为____,按系统命名法命名的名称是____。
(2)化合物B的分子式为____,B在上图转化中发生??反应所属的反应类型是____。
(3)写出D→E反应的化学方程式____。
(4)写出C与E生成G反应的化学方程式____。
(5)E的同分异构体有多种,写出符合下列条件的所有物质的结构简式____。
a.属于芳香族化合物且苯环上的一氯代物有两种;b.含有“ ”基团
”基团
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
化学是以实验为基础的学科,下列有关实验的描述正确的是
A.向两支分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高
B.向100 mL容量瓶中加入4.0 g NaOH固体,然后加水到刻度线,配制1.0 mol/L的NaOH溶液
C.向酸性重铬酸钾溶液中加NaOH,溶液颜色由橙色慢慢变为黄色
D.如图所示,随着空气的通入,试管内液面会慢慢上升至充满整支试管,而后液面又下降

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) + O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) + O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
A、升高温度,可使①②反应速率均加快
B、室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性
C、NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l) ΔH = -346kJ/mol
D、1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
选项 | 离子组 | 加入试剂 | 离子方程式 |
A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+2NH4++Ba2++2OH-===BaSO4↓+2NH3·H2O |
B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-===2H2O+Mg(OH)2↓+2CO32- |
C | K+、NH3·H2O、CO32- | 通入少量CO2 | 2OH-+CO2===CO32-+H2O |
D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+===SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
已知(HF)2(g)  2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
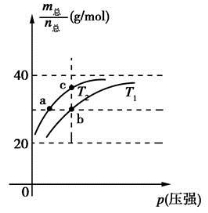
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:vb>va
D.当  时,n(HF):n[(HF)2]=2:1
时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
下列说法正确的是( )
A、煤的液化和气化都是物理变化
B、乙醇、乙酸和甲醛广泛应用于食品加工
C、蛋白质、橡胶和塑料都是天然高分子
D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:实验题
锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
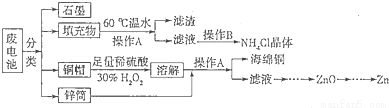
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)操作A的名称为 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式 。
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_______方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:推断题
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
阴离子 | SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______(填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______。
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______(填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为__________________。
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com