
| A. | b、a、d、c、e | B. | e、b、a、d、c | C. | c、b、e、a、b | D. | b、a、e、d、c |
分析 同周期元素从左到右原子半径逐渐减小,对应的元素的金属性逐渐减弱,非金属性逐渐增强,根据对应化合物的碱性、稳定进行判断.
解答 解:A和B的最高价氧化物对应的水化物均呈碱性,则都为金属,且碱性b>a,同周期元素从左到右元素的金属性逐渐减弱,对应的最高价氧化物的水化合逐渐减弱,则原子序数a>b,
同周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增强,c和d的气态氢化物的稳定性c>d,则原子序数c>d;e是这五种元素中原子半径最小的元素,原子序数最大.
则原子序数由小到大的顺序是:b、a、e、d、c,
故选D.
点评 本题考查元素周期律的递变规律,题目难度中等,注意元素的金属性、非金属性与对应化合物的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 100g氨水中含10gNH3•H2O | B. | 10gNH3溶于水形成100g溶液 | ||
| C. | 100g氨水中含10gNH3 | D. | 10gNH3溶于100gH2O形成的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的原子失电子能力比镁强 | B. | 氟的氢化物很稳定 | ||
| C. | 水比硫化氢稳定 | D. | 氢氧化钠比氢氧化镁的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 18.4mol/L H2SO4 | B. | 30mL 3mol/L盐酸 | ||
| C. | 30mL 2mol/L H2SO4 | D. | 30mL 5mol/L HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上重要里程碑 | |
| B. | 在周期表中,把电子层数相同的元素排成一横行,称为一周期 | |
| C. | 元素周期表中,总共有18个纵行,18个族,IIIB族含有32种金属元素 | |
| D. | 第IA族(除H)元素又称为碱金属元素,第ⅦA族元素又称为卤族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
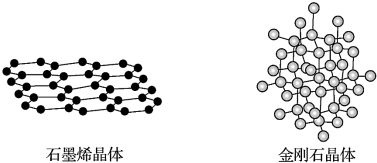
| A. | 在石墨烯晶体中,每个C原子连接3个六元环 | |
| B. | 在石墨烯晶体中,每个六元环占有3个C原子 | |
| C. | 在金刚石晶体中,C原子所连接的最小环为六元环,每个7C原子连接12个六元环 | |
| D. | 在金刚石晶体中,六元环中最多有4个C原子在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
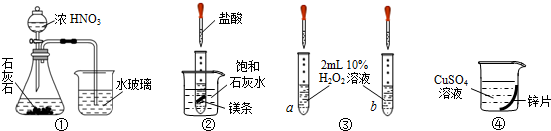
| A. | 实验①烧杯中出现白色胶状沉淀,证明非金属性:N>C>Si | |
| B. | 实验②烧杯中出现白色浑浊,说明镁与盐酸反应是放热反应 | |
| C. | 实验③a、b分别滴加2滴FeCl3溶液、CuSO4溶液,验证不同催化剂对反应速率的影响 | |
| D. | 实验④利用置换反应,证明金属单质还原性强弱,判断金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的还原性:K>Na>Mg>Al | |
| B. | 氢化物的稳定性:HCl<H2S<PH3<SiH4 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | |
| D. | 原子的氧化性:F>Cl>S>P |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com