
��13�֣�ԭ���������������X��Y��Z��M��N����Ԫ�أ�XZ2����������ЧӦ����Ҫ���壬M�����������ǵ��Ӳ�����2������N2+����3d��9�����ӣ���ش��������⣺
��1��Nλ��Ԫ�����ڱ��� ����X��Y��Z�ĵ縺������Ϊ ��
��2��XZ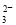 ������ԭ���ӻ���ʽΪ ��
������ԭ���ӻ���ʽΪ ��
��3�� Z���⻯��(H2Z)���Ҵ��е��ܽ�ȴ���H2M����ԭ���� ��
��4��Na2M2Z3��ԭ�Խ�ǿ������Һ���ױ�Cl2������MZ �����������ȼ����÷�Ӧ�����ӷ���ʽΪ ��
�����������ȼ����÷�Ӧ�����ӷ���ʽΪ ��
��5��N��Y���γɵ�һ�־������õĵ�ѧ��ѧ���ܵĻ�����侧���ṹ��ͼ��ʾ����û�����Ļ�ѧʽΪ ��

��13�֣� ��1��ds����2�֣� O��2�֣� ��2��sp2�ӻ���2�֣�
��3��ˮ�������Ҵ�����֮���γ���� ��2�֣�
��4��S2O��4Cl2��5H2O== 2SO��8Cl����10H����3�֣� ��5�� Cu3N��2�֣�
��������
������������������֪��X��C��Y��N��Z��O��M��S��N��Cu����1��29��Ԫ��Cu�ǵ������ڵ�IB��Ԫ�أ����λ��Ԫ�����ڱ���ds����һ������£�ͬһ���ڵ�Ԫ�أ�ԭ������Խ��Ԫ�صķǽ����Ծ�Խǿ��Ԫ�صĵ縺�Ծ�Խ������X��Y��Z�ĵ縺������ΪO����2��CO32-������ԭ���ӻ���ʽΪsp2�ӻ�; ��3�� Z���⻯��(H2O)���Ҵ��е��ܽ�ȴ���H2S������ˮ������Oԭ�Ӱ뾶С���縺�Դ���ˮ�������Ҵ�����֮���γ�������������˷���֮������������ʹ���ܽ������ ����4��Na2S2O3��ԭ�Խ�ǿ������Һ���ױ�Cl2������SO����˳��������ȼ�������ݵ����غ㡢ԭ���غ�������غ㶨�ɿɵø÷�Ӧ�����ӷ���ʽΪS2O��4Cl2��5H2O== 2SO��8Cl����10H������5���ھ����к��е�Nԭ�ӵĸ����ǣ�8��1/8=1,����CuԪ�ظ����ǣ�12��1/4=3�����Ըû�����Ļ�ѧʽΪCu3N��
���㣺����Ԫ�ؼ���������ƶϡ�Ԫ�ص縺�ԵıȽϡ�ԭ�ӵ��ӻ������ʵ��ܽ��ԱȽϡ����ӷ���ʽ����д�����廯ѧʽ��ȷ����֪ʶ��


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ĸ�����ѧ�����п��������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й�ϵ�ı����У���ȷ����
A��0.1mol��L��1NaHSO4��Һ�У�c(Na��)��c(H��)��c(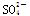 )��c(OH��)
)��c(OH��)
B���к�pH���������ͬ������ʹ��ᣬ����NaOH�����ʵ���֮��Ϊ1:1
C��pH��3�������pH��3��FeCl3��Һ�У�ˮ�����c(H��)�����
D��0.1mol��L��1NaHCO3��Һ�У�c(Na��)>c(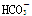 )>c(
)>c(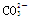 )>c(H2CO3)
)>c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A����CO2ͨ��BaCl2��Һ�������ͣ�������������ͨ��SO2����������
B����ϡ�����м���ͭ�ۣ�ͭ�۲��ܽ⣻�ټ���Cu(NO3)2���壬ͭ���Բ��ܽ�
C����AlCl3��Һ�еμӰ�ˮ��������ɫ�������ټ������NaHSO4��Һ��������ʧ
D����п��ϡ���ᷴӦ�������������ʽ������ټ�������CuSO4���壬���ʲ��ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и���һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�A��B��C��D��E��F����Ԫ�أ�����A��B��C��D��EΪ����������Ԫ�ء�����֮��Ĺ�ϵ���£�
��I��ԭ�Ӱ뾶��A��C��B��E��D
��II��ԭ�ӵ�������������A=D��C=E��A��B=C
��III��ԭ�ӵĺ�����Ӳ�����B=C=2A
������F�ģ�3�������ӻ�̬�۵����Ų�Ϊ3d5
��ش�
��1��Bԭ�ӵĻ�̬ԭ�ӵ����Ų��������ܼ�������ȫ����������״̬����Bԭ�ӵĵ����Ų�ʽΪ ��
��2������A��C��Ԫ�ذ�ԭ�Ӹ�����2��1��ɳ����������VSEPRģ��Ϊ �����ӵ����幹��Ϊ ��
��3������Ԫ���У�A��B��C��E��F����Ԫ�ؿ��γ�һ�ֳ������Σ������ø���������������������Ӹ�����Ϊ1��1��2���������Һ�����ữ��BaCl2��Һ��������ɫ����������NaOH��Һ�����ȣ�������ʹʪ���ɫʯ����ֽ����ɫ�����壬��ø��εĻ�ѧʽ ��Ϊ���鸴����ij��ɫ���ӵĴ��ڣ���д�������ʵ����������� ��
��4��F��+3�������ڼ��������¿ɱ�NaClO����Ϊ+6�۵ĺ���������ӣ�ClO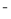 ����ԭΪCl
����ԭΪCl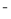 ��д����Ӧ�����ӷ���ʽ ��
��д����Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и���һ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˼����ѧϰ��ѧ����Ҫ˼�룬�ӷ���ĽǶȷ�����ȷ����
A��SO2��NO2����ˮ�������ԣ�������Ƕ�������������
B��Na2O��NH3��ˮ��Һ���ܵ��磬�ʾ�Ϊ�����
C��Si��SiO2������ԭ�Ӿ���
D��Na2O��Na2O2��ˮ��Ӧ��������ǿ��ʶ��Ǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����һ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ��
A��Na2O2����ˮ�Ʊ�O2��2O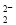 ��2H2O=4OH����O2��
��2H2O=4OH����O2��
B����ϡ����ϴ���Թ��ڱڵ�������Ag+2H��+NO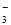 =Ag��+NO��+H2O
=Ag��+NO��+H2O
C����Ba(OH)2��Һ�еμ�NaHSO4��Һ�����ԣ�Ba2����2OH����2H����SO ��BaSO4����2H2O
��BaSO4����2H2O
D�� ������Һ��ͨ������CO2��2C6H5O- + CO2 + H2O  2C6H5OH + CO
2C6H5OH + CO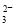
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
��12�֣�����������Na+��K+��Cu2+��H+��NO3����Cl����CO32����OH�������ܴ���������ͬһ��Һ������������Ƿֳ�A��B���飬��֪A����Һ�����ԣ���ÿ���о������������Ӻ����������ӣ�
A�飺 ��
B�飺
��д�����й��̷�Ӧ�����ӷ���ʽ��
��1�������ʯ��ˮ�еμ�����NaHCO3��Һ�� ��
��2����Na2CO3��Һ��ͨ������CO2���壺 ��
��3����������Һ�У���μ���Ba(OH)2��Һ��SO42��������ȫ�� ��
��4����1L 1.0mol?L��1��NaOH��Һ����0.7molCO2���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ��������ϰ�ࣩ10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
(16��)ij����С������H2��ԭ��ɫ��WO3��ĩ�ⶨW�����ԭ����������ͼ�Dzⶨװ�õ�ʾ��ͼ��A�е��Լ������ᡣ

��ش��������⣺
��1��������װ����Լ���B_________ ��D___________��
��2�����Ӻ�װ�ú�Ӧ����_________________________������д������
��3�������ȷ�Ӧ��E���͡���Aƿ��εμ�Һ�塱����������Ӧ���Ƚ��е��� _______________����������֮�仹Ӧ���еIJ�����____________________________
��4��д����Ӧ�����з�Ӧ��E�еĻ�ѧ����ʽ��_______________ ��
��5����ʵ���в������������
�ٿ�E�ܵ�����a �� ��E�ܺ�WO3��������b ���۷�Ӧ��E�ܺ�W�۵�������c����ȴ�����³��������ܷ�ӦǰF�ܼ���ʢ���������d ���ݷ�Ӧ��F�ܼ���ʢ���������e
���������ݿ����г�����W�����ԭ��������������ͬ����ʽ����W�⣬�����漰��Ԫ�ص����ԭ��������Ϊ��֪����
����ʽ1��Ar(W)��____________������ʽ2��Ar(W)��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ���������ѧУ������ѧ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ⷨ�������Ժ�����ˮ(��Ҫ����Cr2O72��)ʱ�����������������������������д��ڷ�ӦCr2O72����6Fe2����14H����2Cr3����6Fe3����7H2O�����Cr3����Cr(OH)3��ʽ��ȥ������˵������ȷ����
A��������ӦΪFe��2e��===Fe2��
B������������ҺpH������
C����������Fe(OH)3��������
D����·��ÿת��12 mol���ӣ������2 mol Cr2O72������ԭ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com