
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
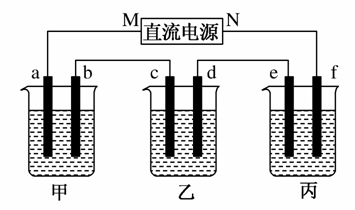
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,②中c电极质量增加。据此回答问题:
(1)电源的N端为________极;
(2)电极b上发生的电极反应为__________________________;
(3)列式计算电极b上生成的气体在标准状况下的体积:_______
_________________________________________________________;
(4)电极c的质量变化是________g;
(5)电解前后各溶液的酸、碱性大小是否发生变化,并简述其原因:
①溶液_______________________________________________;
②溶液_______________________________________________;
③溶液_______________________________________________。
解析 (1)乙中c电极质量增加,则c处发生的反应为:Cu2++2e-===Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。
(2)甲中为NaOH溶液,相当于电解水,OH-在阳极(b)放电,即4OH--4e-===2H2O+O2↑。
(3)丙中为K2SO4溶液,相当于电解水,设电解的水的质量为x g,由电解前后溶质质量相等有:100 g×10%=(100 g-x g)×10.47%,得x=4.5 g,即电解的水的物质的量为0.25 mol。由方程式2H2O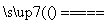 2H2↑+O2↑可知,电解2 mol H2O,转移4 mol电子,所以整个反应中转移0.5 mol电子,而整个电路是串联的,故每个烧杯中电极上转移的电子数是相等的,即b电极转移0.5 mol电子,生成O2为0.5 mol÷4=0.125 mol,标况下的体积为0.125 mol×22.4 L·mol-1=2.8 L。
2H2↑+O2↑可知,电解2 mol H2O,转移4 mol电子,所以整个反应中转移0.5 mol电子,而整个电路是串联的,故每个烧杯中电极上转移的电子数是相等的,即b电极转移0.5 mol电子,生成O2为0.5 mol÷4=0.125 mol,标况下的体积为0.125 mol×22.4 L·mol-1=2.8 L。
(4)Cu2++2e-===Cu,转移0.5 mol电子,则生成铜的质量为:0.5 mol÷2×64 g·mol-1=16 g。
(5)甲中相当于电解水,故NaOH的浓度增大,碱性增大;乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,酸性增大;丙中为电解水,K2SO4溶液的pH不变。
答案 (1)正
(2)4OH--4e-===2H2O+O2↑
(3)水减少的质量:100 g×(1-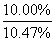 )=4.5 g
)=4.5 g
生成O2体积: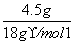 ×
× ×22.4 L·mol-1=2.8 L
×22.4 L·mol-1=2.8 L
(4)16
(5)①碱性增大 因为电解后,水量减少溶液中NaOH浓度增大
②酸性增大 因为在阳极上OH-生成O2,溶液中H+浓度增大
③酸碱性大小没有变化 因为K2SO4溶液呈中性,浓度增加不影响溶液的酸碱性


科目:高中化学 来源: 题型:
在室温下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH减小,但又要使醋酸电离程度减少,应采取( )
A.加入少量CH3COONa固体 B. 通入少量氯化氢气体
C. 升高温度 D. 加入少量氢氧化钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素最高价氧化物的水化物的化学式为HxROy,气态氢化物的化学式为HxR,已知1 mol HxROy比1 mol HxR质量多64 g,又知道1 mol HxROy中R的原子核外电子总数比氢原子和氧原子核外电子总数少16 mol,求R的原子序数。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的标准燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示

C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的开发是当今社会人类面临的严峻课题。回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是( )
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料合算
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乌克兰科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是________________________________________________________。
(3)乙醇是未来内燃机的首选环保型液体燃料,它可以由绿色植物的秸秆制取。1.0 g乙醇完全燃烧生成液态水放出29.72 kJ热量,表示乙醇燃烧的热化学方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH小于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL。下列叙述正确的是( )
A.x=10时,溶液中有NH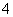 、Al3+、SO
、Al3+、SO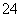 ,且c(NH
,且c(NH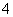 )>c(Al3+)
)>c(Al3+)
B.x=10时,溶液中有NH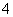 、AlO
、AlO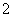 、SO
、SO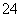 ,且c(NH
,且c(NH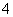 )>c(SO
)>c(SO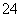 )
)
C.x=30时,溶液中有Ba2+、AlO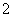 、OH-,且c(OH-)<c(AlO
、OH-,且c(OH-)<c(AlO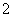 )
)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
B.从一定形式上看,酯化反应也属于取代反应
C.油脂的相对分子质量都较大,所以属于高分子化合物
D.乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
X是第ⅡA族的金属元素,Y是第ⅥA族的非金属元素。那么,由X和Y化合而成的离子化合物的化学式是( )
A.XY B.X2Y
C.XY3 D.X2Y3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com