
| A. | 10 | B. | 12 | C. | 24 | D. | 28 |
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | 含元素R的某种盐可作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
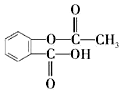
| A. | 乙酰水杨酸的分子式为C9H10O4 | |
| B. | 1mol乙酰水杨酸能与5molH2发生加成反应 | |
| C. | 1mol乙酰水杨酸在NaOH溶液中能与3mol NaOH反应 | |
| D. | 用烃基(-C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
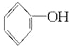 +2Na→2
+2Na→2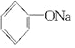 +H2↑
+H2↑ +3Br2→↓+3HBr
+3Br2→↓+3HBr +NaOH→
+NaOH→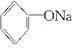 +H2O.
+H2O.| A. | ①和③ | B. | 只有② | C. | ②和③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
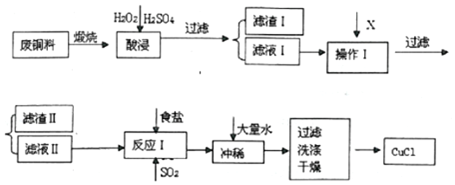
| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.75 | 24.85 | 24.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com