
| A、AlCl3溶液中滴入过量NaOH溶液 | B、Fe2(SO4)3溶液中加入过量铁粉 | C、稀HNO3中加入少量铜片 | D、Ca(ClO)2溶液中通入过量CO2 |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下乙二醇为液态,可用于生产聚酯纤维,其凝固点低,可作发动机抗冻剂 | B、凡含有“-CONH”的化合物均为蛋白质 | C、燃煤烟气用石灰石-石膏法和氨水法脱硫所得的副产品分别为CaSO3和(NH4)2SO4 | D、核磁共振可以检测等效氢的种类比例,仅用核磁共振就可以区分丙酸和丙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、LiH与D2O反应,所得氢气的摩尔质量为4g/mol | B、1mol LiAlH4 125℃完全分解,转移电子数为3NA | C、LiAlH4溶于适量水得到无色溶液,则化学方程式为:LiAlH4+2H2O═LiAlO2+4H2↑ | D、LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 相同条件下NaHCO3的溶解度比Na2CO3的小 | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 |
| B | 钠比铜活泼 | 金属钠可从硫酸铜溶液中置换出铜单质 |
| C | 常温下铝与浓硫酸、浓硝酸均不反应 | 可用铝槽车密封运送浓硫酸、浓硝酸 |
| D | 合成氨反应为吸热反应 | 该反应需在高温条件下进行 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | B、淀粉、纤维素均属于糖类,在人体内可水解为葡萄糖 | C、红外光谱、核磁共振氢谱、原子吸收光谱都可用于有机化合物结构的分析 | D、以苯和乙烯为原料在分子筛固体酸的催化下合成乙苯,该反应符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Ba2+、Cl-、HCO3-
B.0.1 mol·L-1 Na2CO3溶液:K+、NH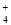 、NO
、NO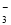 、SO
、SO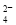
C.0.1 mol·L-1 FeCl3溶液:K+、Na+、I-、SCN-
D. 0.1 mol·L-1 HCl的溶液:Ca2+、Na+、ClO-、NO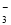
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:填空题
(16分)
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
1/4CaSO4(s)+CO(g) ? 1/4CaS(s)+CO2(g) ?H1 = -47.3kJ?mol-1
② CaSO4(s)+CO(g) ? CaO(s)+CO2(g) +SO2(g) ?H2 = +210.5kJ?mol-1
③ CO(g) ? 1/2C(s)+1/2CO2(g) ?H3 = -86.2kJ?mol-1
(1)反应2CaSO4(s)+7CO(g) ? CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)
的?H=__________(用?H1、?H2和?H3表示)
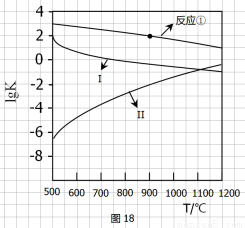
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的?H,回答下列问题。a)曲线中对应反应②的是_______(选填“Ⅰ”或“Ⅱ”)。
归纳lgK-T曲线变化规律: b)_________ ________ 。
c)_____ ___ 。
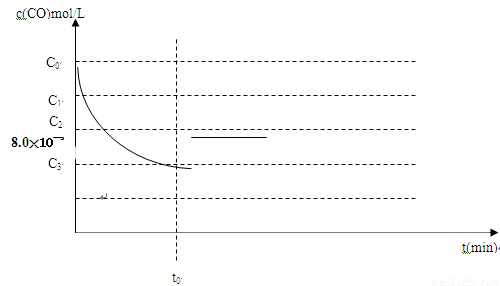
(3)向盛有CaSO4的真空恒容密闭容器中充入初始浓度为C0 mol?L-1 的CO,反应①于900℃
达到平衡,此时c平衡(CO)=8.0X10-5 mol?L-1。
d)用图18中相应的lgK的值计算CO的转化率(忽略副反应,计算结果保留两位有效数字)。
e) c(CO)随反应时间t的变化曲线如图19所示。
若保持其他条件不变,请在答题卡坐标图中分别画出升高反应温度(高于900℃)和降低反应温度(低于900℃)c(CO)随反应时间t的变化曲线图,并作相应的标注(忽略副反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com