
| A、盐酸、硫酸 |
| B、盐酸、NaOH溶液 |
| C、氨水、硫酸 |
| D、氨水、NaOH溶液 |


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
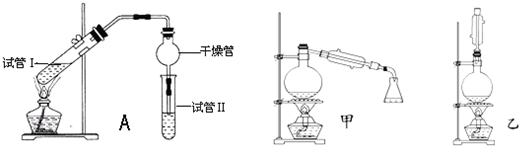
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL 18mol?L-1浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
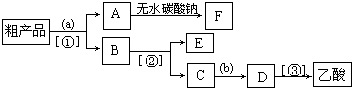
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH HCl CuSO4 MgSO4 |
| B、Na2CO3 K2SO4 BaCl2 HCl |
| C、KNO3 HCl CaCl2 NaOH |
| D、NH4NO3 H2SO4 NaOH MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 |
| B、用焰色反应鉴别NaCl固体和NaOH固体 |
| C、用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| D、用丁达尔效应鉴别NaCl溶液和KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3溶液与过量氨水 |
| B、NaOH溶液与AlCl3溶液 |
| C、NaAlO2溶液与盐酸 |
| D、少量CO2通入CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解池的阴极上都是发生失电子的氧化反应 |
| B、用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 |
| C、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1molNaOH |
| D、酸、碱、盐溶液电解后pH都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com