
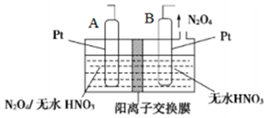
 氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.分析 (1)根据氧化还原反应中得失电子相等结合原子守恒确定另一种生成物,写出相应的反应方程式;N2O与CO2具有相似的结构,应为直线形分子,且存在N=O键,相同原子间形成的共价键是非极性共价键;
(2)由①N2(g)+2O2(g)═2NO2(g)△H=+ckJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-b kJ/mol
③2NO2(g?N2O4(g)△H=-akJ/mol
根据盖斯定律可知②×2-①-③得热化学方程式;
(3)p(NO2)=p总×x(NO2),p(N2O4)=p总×x(N2O4),据此写出平衡常数表达式;
(4)由N2O4制取N2O5需要是失电子,所以N2O5在阳极区生成,A为阳极,B为阴极;
(5)氨水吸收NO2、O2生成硝酸铵,结合原子守恒配平书写化学方程式,溶液呈中性,依据电荷守恒计算可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-),结合平衡常数计算.
解答 解:(1)该反应中化合价变化为:NH4NO3→N2O,N元素由-3价→+1价,一个N原子失去4个电子,由+5价→+1价,一个N原子得4个电子,所以得失电子数的最小公倍数为4,所以硝酸铵的计量数为1,根据原子守恒确定另一种生成物为H2O,然后根据原子守恒配平其它元素,所以该反应的化学方程式为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O,N2O与CO2具有相似的结构,应为直线形分子,且存在N=O键,N2O分子中氧原子只与一个氮原子相连,应为N=N=O结构,
故答案为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O; N=N=O;
(2)由①N2(g)+2O2(g)═2NO2(g)△H=+ckJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-b kJ/mol
③2NO2(g?N2O4(g)△H=-akJ/mol
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=-(c-a+2b)kJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-(c-a+2b)kJ•mol-1 ;
(3)2NO2(g)?N2O4(g),p(NO2)=p总×x(NO2),p(N2O4)=p总×x(N2O4),Kp=$\frac{{P}_{总}×x({N}_{2}{O}_{4})}{({P}_{总}×x(N{O}_{2}))^{2}}$=$\frac{x({N}_{2}{O}_{4})}{{P}_{总}•{x}^{2}(N{O}_{2})}$,
故答案为:$\frac{x({N}_{2}{O}_{4})}{{P}_{总}•{x}^{2}(N{O}_{2})}$;
(4)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,A电极为阳极,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,B为阴极与电源负极相连,
故答案为:负;N2O4+2HNO3-2e-=2N2O5+2H+;
(5)氨水吸收NO2、O2生成硝酸铵,反应的化学方程式为:4NH3•H2O+4NO2+O2=4NH4++4NO3-+2H2O,已知25℃时NH3•H2O的电离常数Kb=2×10-5,向500ml0.1mol•L-1硝酸铵溶液中通入氨气溶液呈中性,c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(NO3-),Kb=$\frac{1{0}^{-7}×0.1}{c(N{H}_{3}•{H}_{2}O)}$=2×10-5,c(NH3•H2O)=$\frac{1{0}^{-8}}{2×1{0}^{-5}}$=5×10-4mol/L,n(NH3)=5×10-4mol/L×0.5L=2.5×10-4mol,
标准状况下氨气体积=2.5×10-4mol×22.4L/mol=0.056L=56ml,
故答案为:4NH3•H2O+4NO2+O2=4NH4++4NO3-+2H2O; 5.6;
点评 本题涉及热化学方程式、化学平衡移动、化学计算、电解原理等知识点,主要是盖斯定律计算、氧化还原反应电子转移、电离平衡常数计算等,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
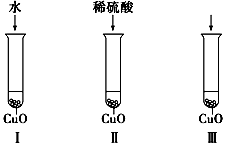 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
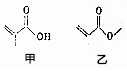
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成和水解反应 | |
| C. | 甲、乙都能使酸性的高锰酸钾褪色 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷分子储存的能量小于异丁烷 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷转化为正丁烷的过程是一个吸热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
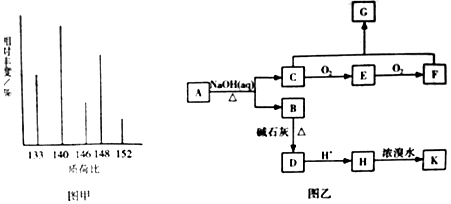
 、K
、K .
.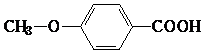 .(本题不考虑
.(本题不考虑 结构).
结构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 实验操作 | 预测的实验现象 |
| B | 向Na2CO3溶液中滴加盐酸 | 立即有气体逸出 |
| C | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 试纸褪色 |
| D | 铅箔在酒精灯火焰上加热 | 铝熔化但不会滴下 |
| 向淀粉的水解液中加入新制Cu(OH)2悬浊液并加热 | 一定有砖红色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com