
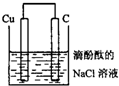
 某学生为探究铜生锈的过程设计如图所示装置,下列选项中正确的是( )
某学生为探究铜生锈的过程设计如图所示装置,下列选项中正确的是( )| A、一段时间后C棒上有气泡冒出,附近的溶液变为红色 | B、一段时间后溶液中会有蓝色沉淀产生 | C、Cu棒为正极,发生:Cu-2e-=Cu2+ | D、C棒为正极,发生:2H++2e-=H2↑ |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com