
分析 根据乙醛的化学式为C2H4O、戊烯的化学式为C5H10,在混合物中碳、氢存在固定的质量比,混合物中一共有三种元素,氧的质量分数为24%,碳、氢元素的质量分数之和为76%,然后可计算出氢元素的质量分数.
解答 解:由乙醛的化学式为C2H4O、戊烯的化学式为C5H10,从化学式可以发现,C与H之间的数目比为1:2,其质量比为12×1:1×2=6:1,又混合物中共三种元素,氧的质量分数为24%,碳、氢元素的质量分数之和为76%,则氢元素的质量分数为76%×$\frac{1}{7}$=10.86%,
故答案为:10.86%.
点评 本题考查学生利用有机物的组成来进行计算,明确碳、氢的固定组成是解答的关键,较好的训练学生分析问题、解决问题的能力,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
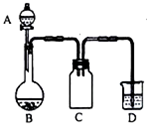 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:| 实验一 证明H2S是弱酸 | 实验操作 | 取VmL未知浓度的H2S溶液,测其pH值为a,再向溶液中加入适量的无水CuSO4粉末,充分反应后再测其pH值为b,用过滤器将溶液中的不容物滤出,并用蒸馏水洗涤不容物,洗净,晾干并称量质量为m克. |
| 分析及结论 | 由实验中的数据可求得H2S溶液的物质的量浓度为:$\frac{1000m}{96V}$mol•L-1; 通过比较a和b数值的大小(或a>b)说明氢硫酸是弱酸. | |
| 实验原理 | 写出上述实验的化学反应方程式:CuSO4+H2S═CuS↓+H2SO4 | |
| 实验二 证明H2S是二元酸 | 实验操作 | 用已知浓度的NaOH溶液去滴定上述H2S溶液 |
| 分析及结论 | 通过实验若得出2n(H2S)=n(NaOH)(或消耗n(NaOH)为n(H2S)的二倍)即可说明H2S是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
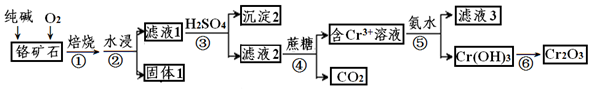
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时A的总转化率为40% | B. | 达到平衡时c(B)为1.0mol•L-1 | ||
| C. | 达到平衡时c(B)=2c(D) | D. | 达到平衡时c(D)为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
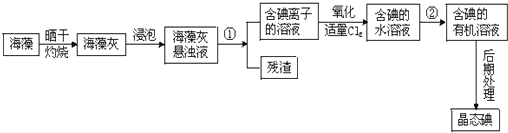
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据Ksp(AgCl)>Ksp( AgBr),可知AgCl的溶解能力比AgBr强 | |
| B. | 加入足量浓AgNO3溶液后,AgCl和AgBr的溶度积Ksp均不变 | |
| C. | 加入足量浓AgNO3溶液后,溶液中只有AgBr沉淀 | |
| D. | 在含有AgBr、AgCl固体的悬浊液中,c (Cl-)>c (Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
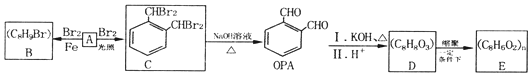
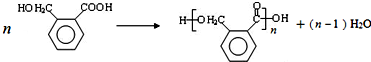 .
.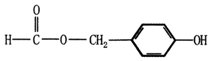 (填结构简式).
(填结构简式). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com