
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO 、NO
、NO 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
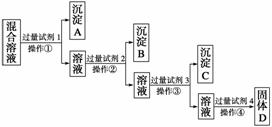
(1)写出上述实验过程中所用试剂的名称:试剂1为______________,试剂2为______________。
(2)控制试剂4的加入量的方法是__________________________。
(3)加入过量试剂3的目的是__________________________________。
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是______________________(填操作名称)。
(5)写出加入试剂4后发生反应的化学方程式:
________________________________________________________________________。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
实验室里做钠跟水反应的实验时,用到的仪器和药品是
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤烧杯 ⑥ 石棉网⑦ 玻璃片 ⑧药匙
A.①②③④ B.②③④⑤⑦
C.①③④⑥⑧ D.②⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。例如:Cu(OH)2(s)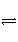
 Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-,Ksp=[Cu2+]·[OH-]2=2×10-20 mol3·L-3。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里[Cu2+]=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.FeCl3溶液与Fe反应:Fe+Fe3+===2Fe2+
C.Cl2氧化Fe2+:Fe2++Cl2===Fe3++2Cl-
D.Al与稀H2SO4反应:2Al+6H+===2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项叙述中,正确的是( )。
A.镁原子由 1s22s22p63s2→1s22s22p63p2 时,原子释放能量,由基态转化成激发态
B.价电子排布为 5s25p1 的元素位于第五周期第ⅠA 族,是 s 区元素
C.所有原子任一能层的 s 电子云轮廓图都是球形,但球的半径大小不同
D.24Cr 原子的电子排布式是1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D同主族,A的原子结构示意图为: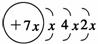 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A________,B________,C________,D________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是________。
(4)画出D的核外电子排布图________,这样排布遵循了________原理和________规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
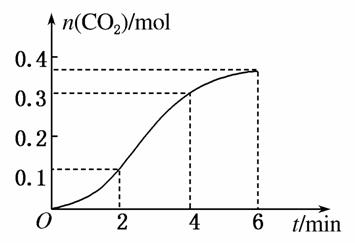
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
日本大地震、海啸引发多处核险情。下列说法中正确的是( )
A.核能是一种清洁、环保、安全的新能源
B.核变化属于化学变化
C.氢气的燃烧热最高,且来源丰富、无污染,是一级能源
D.将煤制成气体燃料或液体燃料,可以提高其燃烧效率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com