
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ,非金属性最强的是F.
,非金属性最强的是F.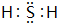 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸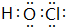 ;
;分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)同周期自左而右原子半径减小;铝离子核外有10个电子,各层电子数为2、8;同周期自左而非金属性增强,同主族自上而下非金属性减弱;
(2)氟元素没有最高价含氧酸,上述元素中最高价氧化物对应的水化物中酸性最强的是高氯酸;钾的金属性最强,故氢氧化钾的碱性最强;Al(OH)3为两性氢氧化物;非金属性越强,对应氢化物越稳定;
(3)⑥的氢化物为H2S,分子中H原子与S原子之间形成1对共用电子对;含有化合价为+1价的⑦的具有漂白性的一种含氧酸为HClO,分子中O原子分别与H原子、Cl原子之间形成1对共用电子对;
(4)同一主族从上到下非金属性减弱,单质的活泼性逐渐减弱,可以根据单质间的置换反应来证明.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
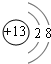
(1)同周期自左而右原子半径减小,故③~⑦中元素中,原子半径最大的是Na,⑤为Al,其离子的结构示意图为 ,同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故上述元素中,最非金属性最强的元素是F,
,同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故上述元素中,最非金属性最强的元素是F,
故答案为:Na; ;F;
;F;
(2)上述元素中除F(F没有正价)外Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,Al(OH)3为两性氢氧化物,F元素非金属性最强,故氢化物中HF最稳定,
故答案为:HClO4;KOH;Al(OH)3;HF;
(3)⑥的氢化物为H2S,电子式为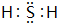 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸为HClO,电子式为
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸为HClO,电子式为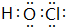 ,
,
故答案为: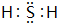 ;
;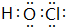 ;
;
(4)同一主族从上到下非金属性减弱,单质的活泼性逐渐减弱,所以氯气的活泼性强于溴单质,可以通过水溶液中的置换反应来证明,反应方程式为:2NaBr+Cl2=2NaCl+Br2,
故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
点评 本题考查位置结构性质的应用,需要学生熟悉元素周期表的结构,注意掌握金属性、非金属性强弱比较实验事实,次氯酸电子式为易错点,容易受化学式的影响.


科目:高中化学 来源: 题型:选择题
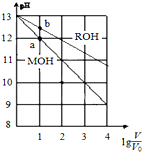 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | MOH的物质的量浓度大于ROH | |
| B. | 水的电离程度:b点大于a点 | |
| C. | 两溶液在稀释过程中,溶液中各离子浓度都减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
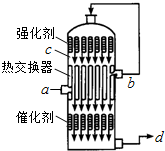 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )| A. | a、b两处的混合气体成分含量相同,温度不同 | |
| B. | c、d两处的混合气体成分含量相同,温度不同 | |
| C. | 热交换器的作用是预热待反应的气体,冷却反应后的气体 | |
| D. | c处气体经热交换后再次催化氧化的目的是提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物的化学式为C3H8 | B. | 该有机物分子中一定含有碳碳双键 | ||
| C. | 该有机物不可能是乙烯 | D. | 该有机物一定含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com