
| A. | n+3 | B. | n-4 | C. | n-6 | D. | n-8 |
分析 X和Y的原子序数都小于18,两者可组成化合物XY3,则X为ⅢA族元素时,Y为ⅤⅡA族元素;或X、Y均为ⅥA族元素;还有可能为X在ⅤA族,Y为ⅤⅡA族或H,以此来解答.
解答 解:X和Y的原子序数都小于18,两者可组成化合物XY3,
若X为ⅢA族元素时,Y为ⅤⅡA族元素,X的原子序数为n,当X与Y同周期,则Y的原子序数=n+4,不同周期时,X为Al、Y为F时,Y的原子序数=n-4,X为B、Y为Cl时,Y的原子序数=n+12;
若X、Y均为ⅥA族元素时,X为S元素、Y为O元素,X的原子序数为n,则Y的原子序数=n-8;
若X在ⅤA族,Y为ⅤⅡA族或H,Y为ⅤⅡA族元素,X的原子序数为n,当X与Y同周期,则Y的原子序数=n+2,不同周期时,X为N,Y为Cl时,Y的原子序数=n+10,X为P、Y为F时,Y的原子序数=n-6;Y为H时,Y的原子序数=n-6或n-15;
综上所述,故Y的原子序数不可能为n+3,
故选A.
点评 本题考查结构性质位置关系,利用列举法解答,注意元素非最高价化合价及氢化物,难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
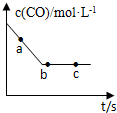 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 探究温度对反应速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、NO3-、H+ | B. | K+、Mg2+、I-、ClO- | ||
| C. | K+、Ba2+、Cl-、Br- | D. | K+、HCO3-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5 s | B. | 大于10 s | C. | 等于10 s | D. | 小于10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
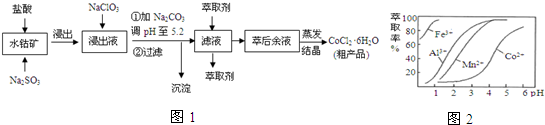
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X分子中不存在手性碳原子 | |
| B. | 一定条件下,X可以发生加聚反应 | |
| C. | 1 mol X跟足量浓溴水反应,最多消耗1 mol Br2 | |
| D. | 1 mol X跟足量NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com