(2011?开封一模)有机物A只含有C.H、O三种元素,常用作有机合成的中间体.16.8g该有机物经燃烧生成44.0g CO
2和14.4g H
2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1.
(1)A的分子式是
C5H8O
C5H8O
.A的结构简式是
;
(2)下列物质中,一定条件能与A发生反应的
ABCD
ABCD
;A.H
2 B.Na C.KMnO
4 D.Br
2(3)有机物B是A的同分异构体,1mol B可与1mol Br
2加成.该有机物所有碳原子在同一个平面,没有顺反异构现象.B中含氧官能团的名称是
醛基
醛基
,B的结构简式是
(CH3)2C=CHCHO
(CH3)2C=CHCHO
;
(4)B可以通过下列变化得到四元环状化合物F请写出反应③化学方程式
(CH3)2CBr-CHBr-COOH+3NaOH→(CH3)2C(OH)-CH(OH)-COONa+2NaBr+H2O
(CH3)2CBr-CHBr-COOH+3NaOH→(CH3)2C(OH)-CH(OH)-COONa+2NaBr+H2O
;上述转化关系中①、②、④的反应类型是:
氧化反应
氧化反应
,
加成反应
加成反应
,
酯化反应
酯化反应
.





 ;
; ,
, ;
; ,含有-OH,能与钠反应、能被酸性高锰酸钾氧化,含有C≡C三键,能与氢气、溴发生加成反应,能被酸性高锰酸钾氧化,故答案为:ABCD;
,含有-OH,能与钠反应、能被酸性高锰酸钾氧化,含有C≡C三键,能与氢气、溴发生加成反应,能被酸性高锰酸钾氧化,故答案为:ABCD;

 全能测控期末小状元系列答案
全能测控期末小状元系列答案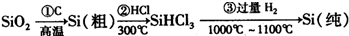


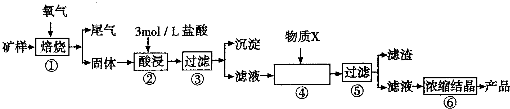

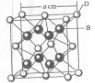 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]