
【题目】在500℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g)2NH3(g)△H=QkJmol﹣1 . 反应过程中能量变化如图所示,回答下列问题: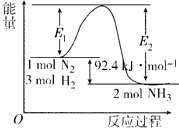
(1)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2 , 充分反应后,放出的热量(填“<”“>”或“=”)46.2kJ,理由是 .
(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol.则该条件下达到平衡时H2的转化率为 . 该温度下的平衡常数K的值为 . 若升高温度,K值(填“增大”“减小”或“不变”).
【答案】
(1)<;此反应为可逆反应,0.5 mol N2和1.5 mol H2不可能完全反应
(2)33.3%;![]() ;减小
;减小
【解析】解:(1)由图可知,1mol N2和3mol H2完全反应放出热量为92.4kJ,此反应为可逆反应,0.5 mol N2和1.5mol H2不可能完全反应,充分反应后,放出的热量<46.2kJ,所以答案是:<;此反应为可逆反应,0.5 mol N2和1.5mol H2不可能完全反应;(2)将一定量的H2(g)和N2(g)放入1L密闭容器中,在500℃、2×107 Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol,则: N2(g)+3H2(g)2NH3(g)
起始量(mol):0.15 0.450
变化量(mol):0.05 0.150.1
平衡量(mol):0.1 0.30.1
氢气转化率= ![]() ×100%=33.3%;
×100%=33.3%;
平衡常数K= ![]() =
= ![]() =
= ![]() ;正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以答案是:33.3%;
;正反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以答案是:33.3%; ![]() ;减小.
;减小.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是( )
A. Na与O2 B. Na2O2与CO2 C. NaOH溶液与CO2 D. C与O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50mg/kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,KI+3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
方法3:I2![]() HIO3
HIO3![]() KIO3
KIO3
(1)与方法3相比方法1的不足是 ,
方法2的不足是。
(2)方法2选用的电极是惰性电极,则其阳极反应式是?
(3)方法3反应温度控制在70 ℃左右,不采用更高温度的主要原因是?
(4)制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用洗涤2~3次,干燥后得产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
A.CH3CH2CH2CH3
B.CH3CH(CH3)2
C.CH3C(CH3)3
D.(CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:
V3++VO2++H2O ![]() VO2++2H++V2+ , 下列说法正确的是( )
VO2++2H++V2+ , 下列说法正确的是( )
A.放电时每转移2mol电子时,消耗1mol氧化剂
B.放电时正极反应为:VO+2+2H++e﹣=VO2++H2O
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区移向阳极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度.实验步骤:①配制500mL浓度约为0.1molL﹣1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度.
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解.该配制步骤(填“可行”或“不可行”).
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期(填“小”或“大”),这是不能直接配制其标准溶液的原因.
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为molL﹣1 , 滴定前将白醋稀释(填“10”或“100”)倍.(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 .
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至即为终点.重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c molL﹣1).
(6)原白醋中醋酸的物质的量浓度=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中链烃的分子式排列规律,判断空格中链烃的同分异构体数目共是(含立体异构)( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C5H12 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com