
| A. | 维生素C具有较强还原性,高温烹饪蔬菜会损失维生素C | |
| B. | 玉米油和鸡蛋清均是高分子化合物,它们均能水解生成氨基酸 | |
| C. | 通过电镀工业可制备铅笔芯,铅笔芯含有大量的铅因此可以导电 | |
| D. | 在水泥路面翻晒的粮食,易受四氯化碳和甲醛等有害物质污染 |
分析 A.维生素C有强还原性,易被氧化;
B.玉米油是油脂,不是高分子,蛋白质水解产生氨基酸;
C.铅笔芯含石墨;
D.水泥是硅酸盐材料.
解答 解:A.维生素C有强还原性,高温烹调时受热易被氧化,故A正确;
B.玉米油是油脂,不是高分子,油脂水解生成丙三醇和高级脂肪酸,鸡蛋清是蛋白质,水解的最终产物是氨基酸,故B错误;
C.铅笔芯的主要成分是石墨,不是金属铅,故C错误;
D.水泥是硅酸盐材料,不会受到有机物的污染,但在水泥路面翻晒粮食是不卫生的,故D错误;
故选A.
点评 本题考查物质的性质及应用,为高频考点,把握环境污染及保护、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 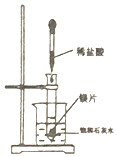 利用图装置,可以研究Ca(OH)2的溶解度随温度的变化 | |
| B. | 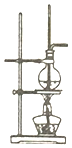 利用图装置,可以利用乙醇制备乙烯 | |
| C. |  利用图装置,可以利用生石灰和NH4C1固体制NH3 | |
| D. | 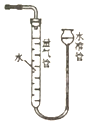 利用图装置,可以测定浓硝酸与铜反应生成的NO2气体体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O2与足量KMnO4反应,转移电子数为2NA | |
| B. | 4.4g CO2和N2O的混合气体含有的原子数为0.3NA | |
| C. | 22.4L NH3含有的电子数为10NA | |
| D. | 25℃、101kPa,2.24LCH4含有的共价键数小于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNaHSO4固体中所含阴阳离子数目总数为3NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 27g铝与lmol/L的盐酸充分反应,转移电子数目为3NA | |
| D. | 标准状况下,44.8升NO与22.4升O2完全反应所得分子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 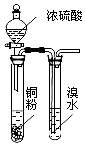 用图所示装置验证浓硫酸具有强氧化性 | |
| B. | 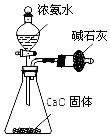 用图所示装罝制取干燥的 NH3 | |
| C. | 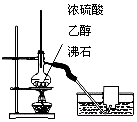 用图所示装置制取并收集乙烯 | |
| D. | 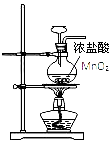 用图所示装置制取 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用含微量NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F以防止蛀牙,则一般可说明后者的Ksp小于前者的Ksp | |
| B. | 室温下向苯和含少量苯酚杂质的混合溶液中加入适量浓溴水,振荡,静置后过滤,可除去苯中少量苯酚杂质 | |
| C. | 用1.00mol/L 标准盐酸滴定未知浓度的NaOH溶液10.00mL,滴定前将25.00mL 酸式滴定管中盐酸调至“0”刻度,将盐酸滴完恰好滴定至终点,则可得c(NaOH)=2.50mol/L | |
| D. | 向4ml 2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL 有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 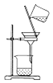 用装置分离Fe(OH)3胶体和NaCl溶液 | |
| B. | 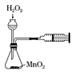 用装置定量测定H2O2的分解速率 | |
| C. |  用装置将CuSO4•5H2O变无水CuSO4 | |
| D. | 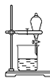 用装置④分离饱和Na2CO3溶液和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com