
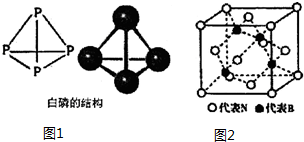
分析 (1)P元素原子价电子排布式为3s22p3;N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,每个面为正三角形;N4分解后能产生N2并释放出大量能量,可以制造火箭推进剂或炸药;
(2)同主族自上而下第一电离能减小;
(3)B原子周围的4个N原子形成正四面体结构;每个晶胞中由8个这样的正四面体结构,只有4个填充B原子;
(4)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径越小,共价键越强,晶体熔点越高;根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)P元素原子价电子排布式为3s22p3,基态原子有3个未成对电子,N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,每个面为正三角形,N-N 键的键角为60°;N4分解后能产生N2并释放出大量能量,可以制造火箭推进剂或炸药,
故答案为:3;sp3;60°;制造火箭推进剂或炸药;
(2)同主族自上而下第一电离能减小,故第一电离能:N>P>As,
故答案为:N>P>As;
(3)B原子周围的4个N原子形成正四面体结构;每个晶胞中由8个这样的正四面体结构,只有4个填充B原子,B原子占据此类空隙的比例为50%,
故答案为:正四面体;50%;
(4)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径N<As、B<Ga,故氮化硼中共价键更强,氮化硼的晶体熔点更高,晶胞中As、Ga原子数目均为4,晶胞质量为4×$\frac{145}{{N}_{A}}$g,晶胞密度为4×$\frac{145}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{5.8×1{0}^{32}}{{N}_{A}•{a}^{3}}$g.cm-3,
故答案为:氮化硼; $\frac{5.8×1{0}^{32}}{{N}_{A}•{a}^{3}}$.
点评 本题考查晶胞的计算,题目难度中等,涉及核外电子排布、杂化方式判断、分子结构、电离能、晶胞结构与计算、熔沸点比较等知识,(3)为易错点、难点,需要学生具备一定的空间想象,注意同周期元素第一电离能异常情况,试题培养了学生的分析能力及灵活应用能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
一定条件下,恒容密闭容器中发生反应2NO(g)?N2(g)+O2(g),图中,曲线a表示该反应在T温度下NO的浓度随时间的变化;曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T温度下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T温度下,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
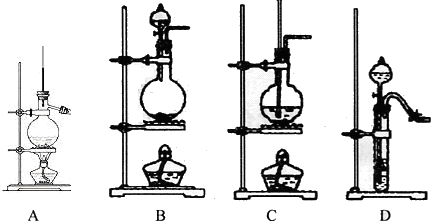
| 实验装置图 |  | 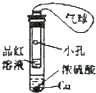 |  | 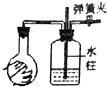 |
| 实验现象 | U形管右侧液面下降 | 小试管中品红溶液褪色 | 加入少量酚酞,溶液变浅红色 | 关闭弹簧夹,双手捂住圆底烧瓶,导管中水柱上升后静止不动 |
| 实验结论 | 该条件下铁钉发生吸氧腐蚀 | 证明二氧化硫具有还原性 | 证明Na2CO3能够发生水解 | 该装置气密性良好 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:乙>丙>丁 | |
| B. | 最高价氧化物对应的水化物的碱性:乙>丙 | |
| C. | 简单气态氢化物稳定性:丁>甲 | |
| D. | 甲和丁组成的化合物在熔融状态下可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z | |
| B. | 氢化物的稳定性:X>Y | |
| C. | 原子失电子能力:W<Z | |
| D. | X与Y形成的简单化合物为离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com