
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
C(s)+![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.
【答案】
(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-704kJ·mol.-1
(2)434kJ/mol
(3)C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJ·mol.-1
(4)46.1kJ;18.44
【解析】
试题分析:(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+![]() O2(g)═CO2(g)+2H2O(l)△H=-704KJ/mol;
O2(g)═CO2(g)+2H2O(l)△H=-704KJ/mol;
(2)H2(g)+Cl2(g)═2HCl(g)△H=-185kJ/mol,E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol,△H=反应物键能总和-生成物键能总和得到:-185kJ/mol=436KJ/mol+243KJ/mol-2E(H-Cl),则E(H-Cl)=432kJ/mol;故答案为:432kJ/mol;
(3)①2Cu(s)+![]() O2(g)═Cu2O(s)△H=-169kJmol-1,
O2(g)═Cu2O(s)△H=-169kJmol-1,
②C(s)+![]() O2(g)═CO(g)△H=-110.5kJmol-1,
O2(g)═CO(g)△H=-110.5kJmol-1,
③2Cu(s)+O2(g)═2CuO(s)△H=-314kJmol-1,
依据盖斯定律②+①-③得到C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;
(4)①图象分析可知,N2和H2反应生成2molNH3过程中能量变化示意图可知反应放热427.2KJ-335KJ=92.2KJ,每生成1molNH3放出热量46.1KJ;故答案为:46.1kJ;
②如图是N2和H2反应生成2molNH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.2KJ/mol
2NH3(g)△H=-92.2KJ/mol
1 30
0.2 0.6 0.4
生成0.4mol氨气放热=![]() ×92,2KJ=18.44KJ,故答案为:18.44。
×92,2KJ=18.44KJ,故答案为:18.44。


科目:高中化学 来源: 题型:
【题目】将足量铁粉放入100 mL 0.1 mol·L-1的CuSO4溶液中,充分反应后析出的铜的质量为( )
A.32 g B.6.4 g C.0.64 g D.3.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的化学性质的叙述,正确的是( )
A.常温时不和任何酸反应 B.常温时可和强碱溶液反应
C.单质硅比碳的还原性强 D.单质硅比碳的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1mol/LCH3COOH溶液的电离平衡的叙述正确的是
A.加水稀释,Ka不会改变
B.加入少量醋酸钠晶体,电离程度增大
C.加水稀释,溶液中粒子浓度都减小
D.升高温度,溶液中粒子浓度都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是( )
A.NH3极易溶于水,可用作制冷剂
B.Al2O3熔点高,可用作耐高温材料
C.SO2具有氧化性,可用于漂白品红、织物等
D.BaCO3能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与工农业生产、生活密切相关,下列说法中正确的是
A. 合成纤维和光导纤维都是新型有机非金属材料
B. 淀粉、纤维素和油脂都属于天然高分子化合物
C. “玉不琢不成器”、“百炼方能成钢”发生的均为化学变化
D. 造纸工艺中使用明矾,会导致纸张发生酸性腐蚀,使纸张变脆,易破损。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
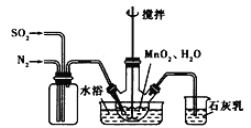
(1)制备MnSO4溶液:在烧瓶中(装置见上图)加入一定量MnO2和水,搅拌,通人SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤。
①写出反应方程式:MnO2+ H2SO3=_________________;
石灰乳参与反应的化学方程式为___________________。
②反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有(填两种)________________、___________________。

③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如上图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异,其中Mn2+对O2与H2SO3反应所起的作用是_________________。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH= 7.7。
请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2O 、Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入_________________,并控制溶液pH_______7.7;
②_______________________;
③_______________________;
④_______________________;
⑤低于100℃干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】現有一定体积的HCl气体,将其溶于l00mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol/L的NaOH溶液l0mL恰好呈中性。继续向所得中性溶液中滴入过量的Ba(OH)2溶液,所得沉淀质量为2.33g。
(1)硫酸的物质的量浓度:__________mol/L
(2)该HCl气体在标准状况下的体积为__________mL.
(3)若向该混酸溶液(仍为100mL)中加入Na2CO3·10H2O晶体,直到不再产生气体时为止, 消耗Na2CO3·10H2O晶体的质量为 _________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质一定为同系物的是( )
A. C2H4O和C3H6O B. C2H4O2和C3H6O2
C. C7H8O和C8H10O D. C3H8和C4H10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com