
【题目】写出下列对应的化学符号
(1)2个硝酸根离子__________
(2)铁锈的主要成分________ 熟石灰的化学式________
(3)硫原子的结构示意图__________硫化钠中硫元素的化合价________
(4)除去氯化钠溶液中的氢氧化钠和碳酸钠,可加入的试剂是________反应的化学方程式是_______________;________;
(5)实验室制取二氧化碳的化学方程式__________
【答案】2NO3- Fe2O3 Ca(OH)2  -2 盐酸 NaOH+HCl=NaCl+H2O Na2CO3+ 2HCl=2NaCl+H2O+CO2
-2 盐酸 NaOH+HCl=NaCl+H2O Na2CO3+ 2HCl=2NaCl+H2O+CO2![]() CaCO3+2HCl=CaCl2+H2O+ CO2
CaCO3+2HCl=CaCl2+H2O+ CO2![]() 。
。
【解析】
(1)2个硝酸根离子2NO3-;
(2)铁锈的主要成分为三氧化二铁,其化学式为Fe2O3 ;熟石灰为氢氧化钙,其化学式Ca(OH)2。
(3)硫原子的结构示意图为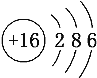 ,硫化钠的化学式为Na2S,根据元素的正负化合价代数和为零,S元素的化合价为-2。答案:-2。
,硫化钠的化学式为Na2S,根据元素的正负化合价代数和为零,S元素的化合价为-2。答案:-2。
(4)因为氢氧化钠和碳酸钠都能和稀盐酸反应,所以要除去氯化钠溶液中的氢氧化钠和碳酸钠可加入的试剂是盐酸,反应的化学方程式是:NaOH+HCl=NaCl+H2O;Na2CO3+ 2HCl=2NaCl+H2O+CO2![]() ;答案:NaOH+HCl=NaCl+H2O;Na2CO3+ 2HCl=2NaCl+H2O+CO2
;答案:NaOH+HCl=NaCl+H2O;Na2CO3+ 2HCl=2NaCl+H2O+CO2![]() 。
。
(5)实验室用大理石和稀盐酸反应制取二氧化碳,其反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2![]() ;答案:CaCO3+2HCl=CaCl2+H2O+CO2
;答案:CaCO3+2HCl=CaCl2+H2O+CO2![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知H2X的溶液中只有一种分子,但存在HX-、X2-等四种离子。常温下向20mL0.2mol/L的H2X溶液中滴加0.2mol/L的NaOH溶液,滴加过程中溶液pH与滴入的NaOH溶液体积关系如图所示,下列说法中正确的是
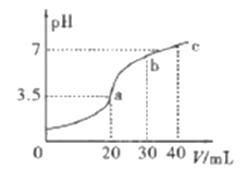
A. X2-+H2O![]() HX-+OH-的平衡常数Kb≈1×10-8
HX-+OH-的平衡常数Kb≈1×10-8
B. a点的溶液中:c(X2-)+c(HX-)<0.1mol/L
C. c点时溶液中:c(Na+)>c(X2-)>c(HX-)>c(OH-)>c(H+)
D. b点时n(Na+)>n(X2-)=n(HX-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12国家食药监总局要求莎普爱思尽快启动临床有效性试验。莎普爱思有效成分是由苄达酸与赖氨酸生成的有机盐,苄达酸结构如图所示。下列关于苄达酸的叙述正确的是

A. 分子式为C16H16N2O3 B. 苯环上的一氯代物有5 种
C. 所有原子可能共平面 D. 属于芳香族化合物,且有弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。下列叙述错误的是
已知:①HA的电离平衡常数:![]()
②pKa=-lgKa
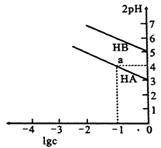
A. 酸性:HA>HB
B. a点对应的溶液中:c(HA)=0.1mol/L,c(H+)=0.01mol/L
C. T℃时,弱酸HB的pKa≈5
D. 弱酸的Ka随溶液浓度的降低而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
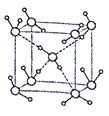
【题目】2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如下图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
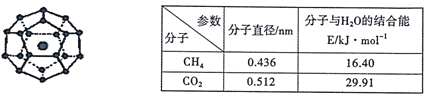
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为_______;碳原子的最高能级的符号是_______,其电子云形状是_______。
(2)CO2分子中碳原子的杂化轨道类型为_______,分子的立体构型为_____。CO2与SO2相同条件下在水中的溶解度较大的是SO2,理由是________。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_______。
(4)“可燃冰”中分子间存在的作用力是氢键和_________,上图中最小的环中连接的原子总数是_______。
(5)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g/cm3到约为水的1.5 倍。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰- Ⅶ的晶体结构为一个如图所示的立方晶胞,每个水分子与周围4个水分子以氢键结合。设O-H…O距离为apm,阿伏加德罗常数的值为NA,则该冰- Ⅶ晶体的密度为____ g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的相对分子质量为84,分子中含有碳碳双键,且分子中只有一种类型的氢。
(1)A的结构简式为____________________。
(2)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。

C的化学名称是_______________;E2的结构简式是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1、以物质的量为中心的计算:
(1)VL Al2(SO4)3溶液中含有Al3+m g,则SO42-的物质的量浓度为____________。
(2)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(3)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
2、将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu=2FeCl2+CuCl2。
(1)请用双线桥法标出电子转移的方向和数目______________________。
(2)该反应中氧化剂是_______________,发生氧化反应的物质是_______________。
(3)当有0.4 mol电子发生转移时,发生反应的Cu的质量为____________。
(4)当有1 mol FeCl3完全反应时,转移的电子数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
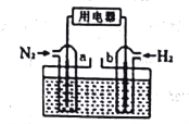
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com