
| A、0 | B、+2 | C、+3 | D、+6 |
科目:高中化学 来源: 题型:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
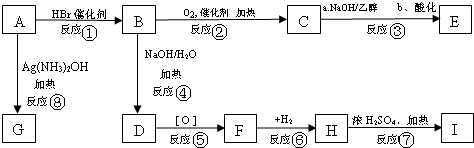
查看答案和解析>>
科目:高中化学 来源: 题型:
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
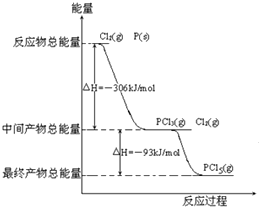 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据). 根据上图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ |
| B、二氧化硅与氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、氯化铝溶液与过量氨水反应:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com