
| O | - 3 |
| O | 2- 4 |
| O | 2- 3 |



 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、K+、AlO2-、Cl-、NO3- |
| B、Na+、CH3COO-、C6H5O-、HCO3- |
| C、Na+、ClO-、SO42-、Cl- |
| D、NH4+、Al3+、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
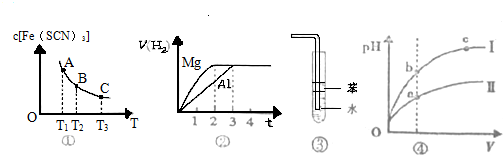
| A、已知图①是体系Fe3++3SCN-?Fe(SCB)3中c[Fe(SCN)3]与温度T的平衡图象,则A点与B点相比,A点的Fe3+浓度大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③可用于吸收HCl气体,并防倒吸 |
| D、图④是某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,II为醋酸稀释时pH的变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| t/min | CO(g)/(mol?L-1) | H2O(g)/(mol?L-1) | CO2(g)/(mol?L-1) | H2(g)/(mol?L-1) |
| 0 | 0.20 | 0.3 | 0 | 0 |
| 3 | 0.08 | 0.18 | c | c |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 化合物 |
A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com