
| CaO(或MgO) | △ |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| △CaO |

查看答案和解析>>
科目:高中化学 来源: 题型:
| CaO(或MgO) | △ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市长宁、嘉定区高三下学期二模化学试卷(解析版) 题型:填空题
硼.碳.氮.硅元素的单质及其化合物是构成自然界的重要物质。
(1)硼元素原子核外电子排布式_________________。氮元素原子的核外电子中,未成对电子数与成对电子数之比为 。
(2)甲烷是最简单的有机物,实验室可通讨下列反应制取: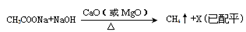 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2 H2O → 8Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断非金属性Si比 H (填“强”.“弱”或“无法比较”)
(4)石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期第一学段考试化学试卷(解析版) 题型:填空题
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于 晶体(填晶体类型)。
②MgO晶体的熔点比CaO高,主要原因是 。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
(3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的
是 (填标号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com