
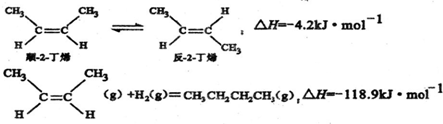
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: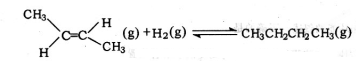 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
分析 A.能量越低越稳定;
B.若生成物相同,反应物的能量高,则放出的热量多;
C.生成正丁烷的反应为气体体积减小的放热反应;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
解答 解:A.顺-2-丁烯转化为反-2-丁烯放热,说明反-2-丁烯能量低,更稳定,故A正确;
B.等量的顺-2-丁烯具有更高的能量.所以顺-2-丁烯燃烧热更大,故B错误;
C.生成正丁烷的反应为气体体积减小的放热反应,所以减压向逆向移动,升温也向逆向移动,所以减压和升温不利于平衡向生成正丁烷反应方向移动,故C错误;
D.将下式-上式相加得到反-2-丁烯氢化的热化学方程式,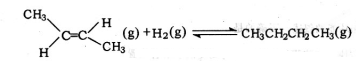 △H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
△H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
故选A.
点评 本题考查能量越低越稳定和盖斯定律、影响平衡的因素等,难度适中,注意掌握运用盖斯定律解题.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含H2SO4的废水用BaCl2处理后排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 化合物 | C/mol.L-1 | c(H+)/mol.L-1 | c(OH-)/mol.L-1 |
| 25 | HA | 1.0×10-2 | 1.0×10-2 | 1.0×10-12 |
| 25 | HB | 1.0×10-2 | 1.0×10-4 | 1.0×10-10 |
| 25 | MOH | 1.0×10-3 | 1.0×10-11 | 1.0×10-3 |
| 100 | MOH | 1.0×10-3 | 1.0×10-8 | 1.0×10-3 |
| A. | 温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 | |
| B. | pH相同的HA和HB的溶液中c(A-)=c(B-) | |
| C. | 相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 | |
| D. | 25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与氧元素形成的化合物中可能含有共价键 | |
| B. | 第三周期元素的简单离子中Y离子的半径最小 | |
| C. | Z、W的氧化物均为酸性氧化物 | |
| D. | R元素含氧酸的酸性一定强于W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com