
| A、醋酸溶液的PH值较大 |
| B、完全中和两溶液,需要浓度相同NaOH溶液的体积相等 |
| C、两者稀释相同倍数后,pH值变化相等 |
| D、加足量的锌充分反应后,两溶液中产生的氢气一样多 |


科目:高中化学 来源: 题型:
| A、该白色粉末中肯定含有Ba(NO3)2、CaCl2、K2CO3 |
| B、该白色粉末中可能含有CaCl2 |
| C、该白色粉末中可能含有Ba(NO3)2 |
| D、该白色粉末中肯定含有Ba(NO3)2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、整个溶液变紫色 |
| B、整个溶液变棕色 |
| C、上层几乎无色,下层紫红色 |
| D、下层几乎无色,上层紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知可逆反应:aA(g)+bB(g)?cC(g),物质的质量分数A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
已知可逆反应:aA(g)+bB(g)?cC(g),物质的质量分数A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1温度时达到化学平衡 |
| B、该反应在T1、T2、T3温度时,均未达到化学平衡 |
| C、升高温度,平衡向正反应方向移动 |
| D、该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2=CH2+HCl
| |||
B、2CH3CHO+O2
| |||
C、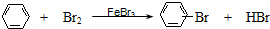 | |||
D、CH3CH2Br+NaOH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.4gNH3含共价键的数目约为0.2×6.02×1023个 |
| B、6.4g Cu投入300 mL 10mol/L的浓硝酸中,充分反应后转移0.2×6.02×1023个电子 |
| C、标准状况下,22.4 L SO2与11.2 L O2,混合充分反应,可得6.02×1023个SO3分子 |
| D、l L 0.5mol/L碳酸钠溶液中含有0.5×6.02×1023个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉的水溶液中大量存在:Fe2+、Cl-、Al3+、I- |
| B、强碱性溶液中可能大量存在:Na+、K+、S2-、[Al(OH)4]- |
| C、常温下pH=7的溶液中大量存在:SO42-、Na+、Cl-、Fe3+ |
| D、无色酸性溶液中可能大量存在:K+、CH3COO-、HCO3-、MnO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com